摘要:关注外界条件对有机反应的影响. 反应物相同.但反应条件(温度.浓度.用量.催化剂.反应介质和操作顺序)不同而导致生成物不同. ⑴温度的影响 R-OH与浓H2SO4- HCOOH+Cu(OH\s\do0(――→ ⑵催化剂的影响 与Br2― (C6H10O5)n- ⑶反应介质的影响 R-X与NaOH-
网址:http://m.1010jiajiao.com/timu3_id_70746[举报]
(2011?东城区二模)(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
其他条件不变时:探究浓度对化学反应速率的影响,应选择
探究温度对化学反应速率的影响,应选择
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是
甲同学设计如下实验流程探究Na2S2O3的化学性质.
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
(Ⅱ)生成白色沉淀B的离子方程式是
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
查看习题详情和答案>>
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
①②
①②
(填实验编号);探究温度对化学反应速率的影响,应选择
①④
①④
(填实验编号).(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
.甲同学设计如下实验流程探究Na2S2O3的化学性质.

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
还原
还原
性.(Ⅱ)生成白色沉淀B的离子方程式是
SO42-+Ba2+=BaSO4↓
SO42-+Ba2+=BaSO4↓
.(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
乙
乙
(填“甲”或“乙”),理由是可以排除BaS2O3的干扰
可以排除BaS2O3的干扰
.(2012?武汉模拟)某同学欲探究Na2S2O3的有关化学性质,设计如下实验流程图.

请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是:
(2)写出生成白色沉淀W所涉及的离子方程式:
(3)将上述流程中所加BaCl2溶液和氯水的顺序颠倒,也得到白色沉淀,能否说明该白色沉淀与 W 为同种物质
(4)取三支大小相同的试管,通过侧定Na2S2O3溶液与稀硫酸反应出现浑浊的时间,研究外界条件对化学反应速率的影响.设计实验表格如下:
①V=
②探究浓度对化学反应速率的影响,应选择
③为了准确控制反应的温度,应采用的加热方式为
查看习题详情和答案>>

请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是:
取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH.
取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH.
(2)写出生成白色沉淀W所涉及的离子方程式:
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
(3)将上述流程中所加BaCl2溶液和氯水的顺序颠倒,也得到白色沉淀,能否说明该白色沉淀与 W 为同种物质
否
否
(填“能”、“否”);(4)取三支大小相同的试管,通过侧定Na2S2O3溶液与稀硫酸反应出现浑浊的时间,研究外界条件对化学反应速率的影响.设计实验表格如下:
| 实验 序号 |
实验 温度/℃ |
0.1mol/LNa2S2O3溶液的体积/mL | H2O的 体积/mL |
0.1mol/LH2SO4溶液的体积/mL | 所需 时间/s |
| 甲 | 25 | 5 | 5 | 2 | / |
| 乙 | 25 | 5 | 6 | 1 | / |
| 丙 | 35 | 5 | 5 | V | / |
2
2
;②探究浓度对化学反应速率的影响,应选择
甲、乙
甲、乙
(填实验编号)组实验进行对比分析;③为了准确控制反应的温度,应采用的加热方式为
水浴加热
水浴加热
.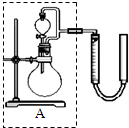 过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.实验室利用反应2H2O2
| ||
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
温度
温度
对H2O2分解速率的影响.实验2、3的目的是
比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异
比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异
实验中可以表明该反应速率差异的现象是
产生气泡的快慢
产生气泡的快慢
②实验室用MnO2做该反应的催化剂,使用如图所示装置的A部分制备O2,避免反应过于剧烈的操作是
旋转分液漏斗的活塞,控制滴加H2O2溶液的速率
旋转分液漏斗的活塞,控制滴加H2O2溶液的速率
.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMNO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
试回答:
根据上表中的实验数据,可以得到的结论是
该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势如图乙所示.该小组同学根据乙图所示信息提出了新的假设,并继续进行实验探究.

该小组同学提出的假设是
请你帮助该小组同学完成实验方案,并填写下表中的空白
若该小组同学提出的假设成立,应观察到的现象为
查看习题详情和答案>>
【实验原理】2KMNO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验 编号 |
室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 |
H2O | 0.2mol/L KMnO4溶液 |
3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
根据上表中的实验数据,可以得到的结论是
其他条件相同时,增大KMnO4浓度反应速率增大
其他条件相同时,增大KMnO4浓度反应速率增大
,试从活化分子和有效碰撞角度解释该结论反应物浓度增大,单位体积内的活化分子数增多,有效碰撞几率增大,反应速率增大
反应物浓度增大,单位体积内的活化分子数增多,有效碰撞几率增大,反应速率增大
.该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势如图乙所示.该小组同学根据乙图所示信息提出了新的假设,并继续进行实验探究.

该小组同学提出的假设是
生成物中的MnSO4(或Mn2+)为该反应的催化剂
生成物中的MnSO4(或Mn2+)为该反应的催化剂
请你帮助该小组同学完成实验方案,并填写下表中的空白
| 实验 编号 |
室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 |
H2O | 0.2mol/L KMnO4溶液 |
3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | MnSO4 MnSO4 (填写所加甲固体的化学式) |
t |
与实验1比较,溶液褪色的时间小于4min
与实验1比较,溶液褪色的时间小于4min
. 硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略).
硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略).(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究
温度
温度
对化学反应速率的影响.(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
| 实验 组号 |
温度 | Na2S2O3溶液 | H2SO4 | 加入H2O的体积 | 出现沉淀所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 10mL | 4s |
其它条件一定时,反应物浓度越大速率越快
其它条件一定时,反应物浓度越大速率越快
;结论2:由Ⅱ和Ⅲ两组数据可知
其它条件一定时,温度越高,速率越快
其它条件一定时,温度越高,速率越快
.