摘要:在一定体积的密闭容器中.进行如下化学反应: CO2(g)+H2+H2O(g),其化学平衡常数K和温度T的关系如下表: T/℃ 700 800 830 1000 1200 K 0.6 0.9 1.0 1.7 2.6 回答下列问题: (1)该反应的化学平衡常数表达式为K= . (2)该反应为 反应. (3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO) (4)某温度下.平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O).试判断此时的温度为 ℃.
网址:http://m.1010jiajiao.com/timu3_id_70617[举报]
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
请回答下列问题:
(1)该反应的化学平衡常数表达式K=
;该反应为
(2)下列说法中能说明该反应达到平衡状态的是
A.容器中压强不变
B.混合气体中c(CO)不变
C.混合气体的密度不变
D.c(CO)=c(CO2)
E.v(H2)=v(H2O)
F.单位时间内生成CO 的分子数与生成CO2 的分子数相等
(3)830℃时在恒容密闭容器中,以表中所示物质的物质的量(单位为mol)发生上述反应:
其中反应开始时,向正反应方向进行的是
(逆)的是
查看习题详情和答案>>
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
吸热
吸热
(填“吸热”或“放热”)反应.(2)下列说法中能说明该反应达到平衡状态的是
BF
BF
(填序号).A.容器中压强不变
B.混合气体中c(CO)不变
C.混合气体的密度不变
D.c(CO)=c(CO2)
E.v(H2)=v(H2O)
F.单位时间内生成CO 的分子数与生成CO2 的分子数相等
(3)830℃时在恒容密闭容器中,以表中所示物质的物质的量(单位为mol)发生上述反应:
| 实验编号 | a(H2) | n(CO2) | n(CO) | n(H2O) |
| A | 2 | 3 | 1 | 5 |
| B | 1 | 1 | 2 | 2 |
| C | 1.2 | 1.2 | 0.8 | 1.8 |
A
A
(填实验编号,下同);反应开始时,v(正)=v (逆)的是
C
C
.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数K=
(2)该反应为
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率
(4)830℃,在1L的固定容器的密闭容器中放入2mol CO2和1mol H2,平衡后H2的转化率为多少?
.
查看习题详情和答案>>
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)该反应为
吸热
吸热
反应.(填“吸热”或“放热”)(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率
小
小
(填“大”“小”或“不能确定”)(4)830℃,在1L的固定容器的密闭容器中放入2mol CO2和1mol H2,平衡后H2的转化率为多少?
| 2 |
| 3 |
| 2 |
| 3 |
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
如图所示是反应I反应过程中的能量变化曲线.
(1)由图可知反应I为
放热
放热
反应(选填”吸热、放热”),反应热△H1=-91kJ/mol
-91kJ/mol
.(2)反应I在一定体积的密闭容器中进行,能判断其是否达到化学平衡状态的依据是
AB
AB
.A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(CH3OH)
D.c(CO)=c(CH3OH)
(3)图中曲线
b
b
表示使用催化剂时反应的能量变化.(4)一定条件下,向体积为2L的密闭容器中充入2mol CO2和6mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数数K值=
| 4 |
| 27 |
| 4 |
| 27 |
50%
50%
,若平衡后在充入4mol的N2,则c(CO2)是0.5mol/L
0.5mol/L
.(5)从绿色化学的角度比较上述两种方法,符合原子经济的是
Ⅰ
Ⅰ
.(填“Ⅰ”或“Ⅱ”)一定条件下,在一定体积的密闭容器中一定量的物质A、B发生反应:aA(g)+bB(g)?xC(g)达到化学平衡,并有图1所示的变化关系,其中C%表示平衡混合气中C的体积分数,T为温度,ρ为压强,t为时间.则在图2中,Y轴表示的是( )
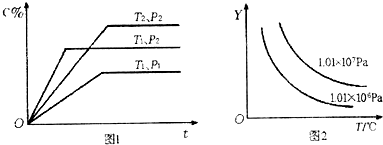

| A、平衡混合气中A或C的体积分数 | B、平衡混合气的密度 | C、平衡时,A或B的转化率 | D、平衡时,C的物质的量浓度 |
在一定体积的密闭容器中,进行如下化学反应:C(S)+H2O(g)
CO(g)+H2(g),其化学平衡常数K和温度T的关系如
下表:
回答下列问题:
(1)该反应为
(2)能判断该反应是否达到化学平衡状态的依据是
(a)容器中压强不变(b)混合气体中c(CO)不变
(c)υ逆(H2)=υ正(H2O)(d)c(H2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,缩小容器的体积.平衡向
(4)若830℃时,向容器中充入1mol CO、5mol H2,反应达到平衡后,其化学平衡常数K
查看习题详情和答案>>
| 催化剂 |
下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
(1)该反应为
吸热
吸热
反应(选填“吸热”、“放热”).(2)能判断该反应是否达到化学平衡状态的依据是
abc
abc
.(a)容器中压强不变(b)混合气体中c(CO)不变
(c)υ逆(H2)=υ正(H2O)(d)c(H2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,缩小容器的体积.平衡向
逆反应方向
逆反应方向
移动(选填“正反应方向”、“逆反应方向”、“不”).(4)若830℃时,向容器中充入1mol CO、5mol H2,反应达到平衡后,其化学平衡常数K
等于
等于
1.0(选填“大于”、“小于”、“等于”)