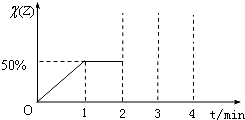
摘要:2.在120℃时.向密闭容器中充入H2S和O2的混合气体100 mL.用电火花引燃.经充分反应后.恢复到原状态.测定容器内残留气体体积为V mL. (1)讨论V和x(x表示100 mL混合气体中O2体积)函数式. (2)若残留气体体积V=90 mL.求原混合气体的组分.
网址:http://m.1010jiajiao.com/timu3_id_68559[举报]
将H2S和O2的混合气体, 在120℃时装入一密闭容器中, 高温下使之反应, 已知H2S 和O2全部都参加了反应. 反应后, 将温度恢复到120℃, 测得压强为反应前的3/4倍, 则原混合气体中H2S和O2的物质的量之比是
[ ]
A.2∶1 B.1∶2 C.1∶1 D.1∶3
查看习题详情和答案>>工业合成氨的反应(N2+3H3═2NH3)是一个放热反应.
(1)相同条件下,1mol N2和3mol H2所具有的能量
(2)实验室模拟工业合成氨时,向密闭容器内充入10mol N2、30mol H2,在一定条件下发生反应.
①若密闭容器的体积为2L,反应经过10min后,测得容器内的NH3为10mol,则用N2表示的该反应速率为
②若保持容器的容积不变,反应一段时间后,测得容器内下列各项性质保持不变.其中不能说明合成氨反应已经达到化学平衡状态的是
a.压强 b.密度 c.分子数 d.气体体积 e. 气体质量 f.NH3的物质的量的分数.
查看习题详情和答案>>
(1)相同条件下,1mol N2和3mol H2所具有的能量
>
>
(填“>”、“<”或“=”)2mol NH3具有的能量;在相同条件下,若断开1mol N2、3mol H2和2mol NH3中的化学键时,吸收的能量分别为Q1、Q2、Q3,则Q1+Q2<
<
Q3(填“>”、“<”或“=”);在一定条件下,当该反应生成2molNH3时,放出92kJ的热量,该条件下,如果将1mol N2和3mol H2混合,使其充分反应,放出的热量<
<
92kJ(填“>”、“<”或“=”).(2)实验室模拟工业合成氨时,向密闭容器内充入10mol N2、30mol H2,在一定条件下发生反应.
①若密闭容器的体积为2L,反应经过10min后,测得容器内的NH3为10mol,则用N2表示的该反应速率为
0.25mol.L-1.min-1
0.25mol.L-1.min-1
,此时容器内H2的浓度为7.5mol.L-1
7.5mol.L-1
.②若保持容器的容积不变,反应一段时间后,测得容器内下列各项性质保持不变.其中不能说明合成氨反应已经达到化学平衡状态的是
bde
bde
.a.压强 b.密度 c.分子数 d.气体体积 e. 气体质量 f.NH3的物质的量的分数.
已知常温下,N2(g)和H2(g)生成2mol NH3(g)放出92.4kJ热量.现有甲、乙两个容积相同的密闭容器,在常温下:
①向密闭容器甲中通入1mol N2和3mol H2,达到平衡时放出热量Q1kJ.
②向密闭容器乙中通入0.5mol N2和1.5mol H2,达到平衡时放出热量Q2 kJ.
则下列关系式正确的是( )
①向密闭容器甲中通入1mol N2和3mol H2,达到平衡时放出热量Q1kJ.
②向密闭容器乙中通入0.5mol N2和1.5mol H2,达到平衡时放出热量Q2 kJ.
则下列关系式正确的是( )
查看习题详情和答案>>