摘要:X.Y.Z.W是原子序数依次增大的短周期元素.且互不同族.其中只有一种为金属.X的核外电子排布式为nsnnpn.Z的最外层电子数是其电子层数的2倍. Y原子与Z原子的最外层电子数之和为9.且Y和W单质都可与烧碱溶液反应.请回答以下问题: (1)Y.Z.W的原子半径由大到小的顺序是 (2)XZ2的电子式是 .空间结构为 .形成晶体时属于 晶体. (3)Y的价电子排布式是 .工业上生产单质Y的原理是 (
网址:http://m.1010jiajiao.com/timu3_id_66065[举报]
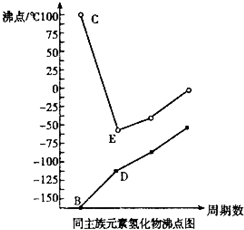 X、Y、Z、W是原子序数依次增大的四种短周期元素,X和Z,Y和W分别同主族.B、C、D、E分别为X、Y、Z、W的氢化物,它们的沸点如图
X、Y、Z、W是原子序数依次增大的四种短周期元素,X和Z,Y和W分别同主族.B、C、D、E分别为X、Y、Z、W的氢化物,它们的沸点如图(1)元素Z、W的名称:Z
(2)比较元素X、W的非金属性强弱(用元素符合回答)
(3)C的沸点反常的原因是
(4)由元素X、Y、Z形成的两种化合物ZX、ZY2具有相同的晶体类型,都属于
X、Y、Z、W是原子序数依次增大的四种短周期元素,且四种元素的原子序数之和为32.其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻,Z、W位于同一主族.
请回答下列问题:
(1)X是
(2)X与Y组成的最简单化合物的电子式为
 .
.
(3)由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的离子方程式为
(4)由X、Y、Z、W四种元素组成一种离子化合物A.
①已知在加热条件下1mol A能与足量的NaOH溶液反应生成标准状况下44.8L气体.写出在加热条件下A与NaOH溶液反应的离子方程式:
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
(5)由X、Y、Z、W和Fe五种元素可组成相对分子质量为392的化合物B,已知1mol B中含有6mol结晶水.现对化合物B进行如下实验:
a.向B的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色.
b.另取少量B的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解.
由上述实验可推出B的化学式为
查看习题详情和答案>>
请回答下列问题:
(1)X是
H
H
(填元素符号).(2)X与Y组成的最简单化合物的电子式为


(3)由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的离子方程式为
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(4)由X、Y、Z、W四种元素组成一种离子化合物A.
①已知在加热条件下1mol A能与足量的NaOH溶液反应生成标准状况下44.8L气体.写出在加热条件下A与NaOH溶液反应的离子方程式:
H2O+SO32-+Cl2=2Cl-+SO42-+2H+
H2O+SO32-+Cl2=2Cl-+SO42-+2H+
.②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
H2O+SO32-+Cl2=2Cl-+SO42-+2H+
H2O+SO32-+Cl2=2Cl-+SO42-+2H+
.(5)由X、Y、Z、W和Fe五种元素可组成相对分子质量为392的化合物B,已知1mol B中含有6mol结晶水.现对化合物B进行如下实验:
a.向B的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色.
b.另取少量B的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解.
由上述实验可推出B的化学式为
(NH4)2Fe(SO4)2?6H2O
(NH4)2Fe(SO4)2?6H2O
.X、Y、Z、W是原子序数依次增大的前36号元素中的常见元素,其相关信息如下表:
(1)W位于元素周期表中第 周期 族,与Y同主族且与W同周期元素的基态原子核外电子排布式是 .
(2)X、Y、Z的最高价氧化物的水化物中,酸性最弱的酸是 (写化学式,下同);在WZ和XZ2两
化合物中,熔点较高的是 .
(3)氯化物ZCI2与过量氢化物YH3在无水条件下反应生成Z4Y4、单质Z和一种可以作化肥的物质,请写出相
应化学方程式 .
(4)已知:4W(s)+02(g)=2W20(s)AH=-337.2kJ.mol-l
2X(s)+02(g)=2XO(g)△H=-211.0kJ.mol-1
试计算:W20(s)+X(s)=2W(s)+XO(g)△H= kJ. mol-1.
查看习题详情和答案>>
| 元素 | 相关信息 |
| X | 同素异形体之一自然界最硬 |
| Y | 与X同周期,且最高正价与最低负价代数和为2 |
| Z | 单质用于制黑火药,燃烧时有强烈的刺激性气味 |
| W | 基态原子只有一个未成对电子,单质及其合金 在潮湿的空气中容易出现绿色锈迹 |
(2)X、Y、Z的最高价氧化物的水化物中,酸性最弱的酸是
化合物中,熔点较高的是
(3)氯化物ZCI2与过量氢化物YH3在无水条件下反应生成Z4Y4、单质Z和一种可以作化肥的物质,请写出相
应化学方程式
(4)已知:4W(s)+02(g)=2W20(s)AH=-337.2kJ.mol-l
2X(s)+02(g)=2XO(g)△H=-211.0kJ.mol-1
试计算:W20(s)+X(s)=2W(s)+XO(g)△H=