网址:http://m.1010jiajiao.com/timu3_id_65038[举报]
(1)下列实验操作正确的是________(填编号).
A、向一支洁净的试管中加人1mL 2% 硝酸银溶液,再向试管中滴加2%
的稀氨水至最初产生的沉淀恰好溶解为止.再滴加3滴乙醛溶液,振荡后热水浴中温热,片刻后试管内壁形成银镜.
B、实验室制取乙烯时,必须将温度计的水银球插入反应液中.
C、取2mL 10% NaOH溶液于试管中,加入4mL 2%
CuSO4溶液,振荡后再加入某种有机试剂,热水浴中温热,可根据是否产生红色沉淀判断该有机物中是否含有醛基.
D、取20mL蒸馏水于50mL烧杯中,加热至沸,向沸水中滴加1 mL ~2mL FeCl3饱和溶液,持续加热片刻,即可制得Fe(OH)3胶体.
(2)已知5I-+IO3-+6H+=3I2+3H2O,现只提供KI试剂,请利用家庭用品,设计一实验证明你家中食用盐是否属含碘(KIO3)盐.________.
(16分)
Ⅰ.下列操作正确的是_______.
| A.用氨水清洗做过银镜反应的试管 |
| B.用酒精清洗有硫沉淀的试管 |
| C.用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO4溶液; |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
F、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
G、用托盘天平称取10.50 g干燥的NaCl固体;
H、向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
I、配制Al2(SO4)3溶液时,加入少量的稀硫酸。
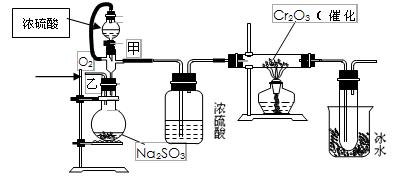
Ⅱ.用下图装置进行SO2转化为SO3的转化率测定实验:

(1)写出圆底烧瓶中发生反应的化学方程式
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程) 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(4)本实验装置设计中有不恰当的地方,请指出: 。
所增加装置的目的是 。
(5)将反应生成的44.8L(标况下)SO2气体全部通过硬质玻璃管后,在右侧烧杯的试管中得到152g固体,则SO2的转化率为 查看习题详情和答案>>
Ⅰ.下列操作正确的是_______.
| A.用氨水清洗做过银镜反应的试管 |
| B.用酒精清洗有硫沉淀的试管 |
| C.用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO4溶液; |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
F、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
G、用托盘天平称取10.50 g干燥的NaCl固体;
H、向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
I、配制Al2(SO4)3溶液时,加入少量的稀硫酸。
Ⅱ.用下图装置进行SO2转化为SO3的转化率测定实验:
(1)写出圆底烧瓶中发生反应的化学方程式
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程) 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(4)本实验装置设计中有不恰当的地方,请指出: 。
所增加装置的目的是 。
(5)将反应生成的44.8L(标况下)SO2气体全部通过硬质玻璃管后,在右侧烧杯的试管中得到152g固体,则SO2的转化率为
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质.
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________.
A.冷水
B.沸水
C.NaOH浓溶液
D.NaCl浓溶液
(2)现有甲、乙、丙、丁四名同学进行Fe(OH)3胶体的制备
①甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,用玻璃棒搅拌,继续煮沸至溶液呈红褐色,停止加热.请评价该操作是否正确________.
②乙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________.
(3)写出制备Fe(OH)3胶体的化学方程式:________.
(4)怎样检验制备的物质是否为胶体?________.
(5)取少量你制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是________,这种现象称为胶体的________.
(6)氢氧化铁胶体稳定存在的主要原因是________.
A.胶粒直径小于1 nm
B.胶粒带正电荷
C.胶粒作布朗运动
D.胶粒能透过滤纸
(10分)某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙、丁四名同学进行Fe(OH)3胶体的制备
① 甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,用玻璃棒搅拌,继续煮沸至溶液呈红褐色,停止加热。请评价该操作是否正确______________。
② 乙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确____________。
(3)写出制备Fe(OH)3胶体的化学方程式:__________________________。
(4)怎样检验制备的物质是否为胶体?____________________________。
(5)取少量你制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是______________,这种现象称为胶体的____________。
(6)氢氧化铁胶体稳定存在的主要原因是__________。
A.胶粒直径小于1 nm B.胶粒带正电荷
C.胶粒作布朗运动 D.胶粒能透过滤纸
查看习题详情和答案>>