摘要: ⑴ 从图中可以看出.1mol混合烃完全燃烧生成CO2比H2O的物质的量少0.4mol, ⑵ ①CH4.C2H4 2∶3 ②CH4.C3H4 7∶3 ③CH4.C4H4 4∶1
网址:http://m.1010jiajiao.com/timu3_id_63691[举报]
 (2011?开封一模)[化学--选修物质结构与性质]
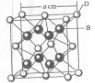
(2011?开封一模)[化学--选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如图.请回答:
(1)A与c形成的共价化合物的分子式是
SiH4
SiH4
,杂化轨道是sp3
sp3
,分子的立体结构是正四面体
正四面体
.(2)B与C比较,电负性较小的是
Si
Si
(填元素符号);B与c形成的化合物晶体类型是分子晶体
分子晶体
. (3)E属元素周期表中第
四
四
周期,第ⅡB
ⅡB
族的元素,其元素名称是锌
锌
,它的+2价离子的电子排布式为1s22s22p63s2sp63d10
1s22s22p63s2sp63d10
.(4)从图中可以看出,D踉B形成的离子化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
 【化学一一选修物质结构与性质】
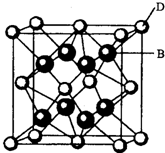
【化学一一选修物质结构与性质】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如图所示.
请回答下列问题.
(1)E元素原子基态时的电子排布式为
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因主要是
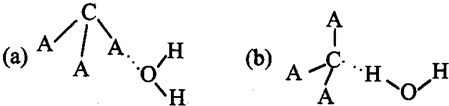
(4)从图中可以看出,D跟B形成的离子化合物的化学式为
要使垃圾中宝贵的再生资源得到充分利用,必须对垃圾进行分类,不同地区分类方法不同.如图是一些地区采用的垃圾分类图标.

(1)图C的文字已模糊不清,从图中可以看出它表示的是
A.可回收物 B.可堆肥垃圾 C.可燃垃圾 D.有害垃圾
(2)上述各图中适宜于堆肥处理的垃圾是
(3)图D表示的垃圾若随意丢弃,会造成环境污染,这种污染通常称为
(4)图A废电池需要集中处理,主要原因是电池中含有的
查看习题详情和答案>>

(1)图C的文字已模糊不清,从图中可以看出它表示的是
D
D
A.可回收物 B.可堆肥垃圾 C.可燃垃圾 D.有害垃圾
(2)上述各图中适宜于堆肥处理的垃圾是
B
B
(3)图D表示的垃圾若随意丢弃,会造成环境污染,这种污染通常称为
白色污染
白色污染
(4)图A废电池需要集中处理,主要原因是电池中含有的
含有重金属离子
含有重金属离子
掺入生活垃圾中进行填埋时,会通过渗液污染水体和土壤.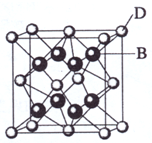 (2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.
(2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.请回答:
(1)A元素的名称是
氢
氢
;(2)B的元素符号是
F
F
,C的元素符号是Cl
Cl
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是氟化氢分子间存在氢键,氯化氢分子间没有氢键
氟化氢分子间存在氢键,氯化氢分子间没有氢键
(3)E属元素周期表中第
四
四
周期,第VIIB
VIIB
族的元素,其元素名称是锰
锰
,它的+2价离子的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
:(4)从图中可以看出,D跟B形成的离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g?cm-3,则晶胞的体积是| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
 (1)美国“阿特兰蒂斯号”航天飞机与2009年5月11日升空修复含勃望远镜,它使用的燃料是液氢和液氧.已知下列热化学方程式:
(1)美国“阿特兰蒂斯号”航天飞机与2009年5月11日升空修复含勃望远镜,它使用的燃料是液氢和液氧.已知下列热化学方程式:H2(l)+
| 1 | 2 |
H2O(l)=H2O(g);△H=+44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:
(2)在利用CaCO3与盐酸反应制取二氧化碳的反应中,反应中生成二氧化碳的体积与反应的时间关系如图所示,两个实验所用的盐酸浓度相同,其中一个实验用的是石灰石块,另一实验用的是石灰石粉末,则从图中可以看出:使用石灰石块的是
(3)已知反应X(g)+2Y(g)?2Z(g),如右图所示,相同温度下,在甲、乙两容器中各投入1mol X、2mol Y和适量催化剂,甲乙两容器的初始体积均为1L,乙活塞可自由滑动.甲、乙 达到平衡所用时间:甲