网址:http://m.1010jiajiao.com/timu3_id_63437[举报]
CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4 (g)+3O2(g) △H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
|
CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[著轰击],CO2的转化率 (填“增大”“减小”
“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
(3)定条件下,将3 rrlolH2和ImolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
a.该条件下此反应的化学平衡常数表达式为
![]()
b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其![]() 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为![]() ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
 2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:
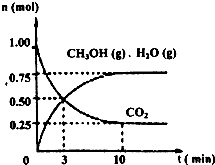
某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施中一定不能使n(CH3OH)/n(CO2)增大的是:
A.降低温度 B.缩小容器的容积 C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO 2水溶液的pH=5.6,c(H2CO3)=1.5×l0-5mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的电离平衡常数K=
(3)标准状况下,将1.12LCO2通入100mL 1mol?L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示
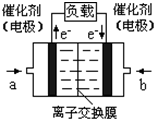 意图,则a处通入的是
意图,则a处通入的是b处电极上发生的电极反应是:
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
(15分)2009年12月7日~18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)
随时间变化如图所示:
①从反应开始到平衡,氢气的平均反应速 (H2)=_______。
(H2)=_______。
②下列措施中一定不能使 (CH3OH)/ (CO2)增大的是_______。
A.降低温度 B.缩小容器的容积
C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+的电离平衡常数K=________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为________;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处的通入的是_____(填“乙醇”或“氧气”),b处电极上发生的电极反应是________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看习题详情和答案>>
(14分)“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1) 其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) ="=" C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) ="=" C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g) +2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
| | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
① 温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”“减小”“不变”)。
② 该反应的正反应为 (填“吸”或“放”)热反应。
(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+ CO2(g)
 CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是 。
CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是 。a. 该条件下此反应的化学平衡常数表达式为
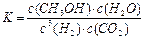
b. H2的平均反应速率为0.3mol/(L·s)
c. CO2的转化率为60%
d. 若混合气体的密度不再改变时,该反应一定达到平衡状态
|
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为大于 。 查看习题详情和答案>>
 温度(K)
温度(K)