摘要:9.向100mL 0.1mol/L的NaOH溶液中通入224mLCO2气体.恰好完全反应.则所得溶液中粒子浓度关系正确的是 A.c (Na+ )=c (HCO3- )+c (H2CO3)+c (CO32- ) B.c (Na+ )>c (HCO3- )>c (H + )>c (CO32- )>c (OH - ) C.c (Na+ )+c (H + )=c (HCO3- )+c (OH - )+c (CO32- ) D.c (H + )+c (H2CO3)=c (CO32- )+c (OH - )
网址:http://m.1010jiajiao.com/timu3_id_63275[举报]
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:

(1)NH4Al(SO4)2可作净水剂,其理由是
(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol?L-1 NH4Al(SO4)2中c(NH
)
).
(3)如图1所示是0.1mol?L-1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol?L-1 NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol?L-1 NH4Al(SO4)2中2c(SO
)-c(NH
)-3c(Al3+)=
(4)室温时,向100mL 0.1mol?L-1 NH4HSO4溶液中滴加0.1mol?L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大是
查看习题详情和答案>>

(1)NH4Al(SO4)2可作净水剂,其理由是
Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水
Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水
(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol?L-1 NH4Al(SO4)2中c(NH
+ 4 |
小于
小于
(填“等于”“大于”或“小于”)0.1mol?L-1 NH4HSO4中c(NH+ 4 |
(3)如图1所示是0.1mol?L-1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol?L-1 NH4Al(SO4)2的pH随温度变化的曲线是
Ⅰ
Ⅰ
(填写序号),导致pH随温度变化的原因是NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小
NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小
;②20℃时,0.1mol?L-1 NH4Al(SO4)2中2c(SO
2- 4 |
+ 4 |
10-3mol?L-1
10-3mol?L-1
(填数值).(4)室温时,向100mL 0.1mol?L-1 NH4HSO4溶液中滴加0.1mol?L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大是
a
a
点;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
. 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl(1)属于弱电解质的是
③④
③④
,溶液呈碱性的有②④⑤
②④⑤
(填序号).(2)常温下0.01mol/L HCl溶液的PH=
2
2
;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=10-3mol/L
10-3mol/L
.(3)用离子方程式表示CH3COONa溶液呈碱性的原因
CH3COO?+H2O?CH3COOH+OH?
CH3COO?+H2O?CH3COOH+OH?
,其溶液中离子浓度按由大到小的顺序为c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
.(4)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m
小于
小于
n (填“大于、等于、小于”).(5)常温下,向100mL 0.01mol?L-1HA溶液逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为
强
强
酸(填“强”或“弱”).②K点对应的溶液中,c(M+)+c(MOH)=
0.01
0.01
mol?L-1. (2010?金华模拟)已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是( )
(2010?金华模拟)已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是( )
查看习题详情和答案>>
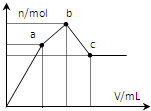 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液. 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液. 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )