摘要: 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.还可制备硫及铁的化合物. (1)冶炼铜的反应为 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2 若CuFeS2中Fe的化合价为+2.反应中被还原的元素是 . (2)上述冶炼过程产生大量SO2.下列处理方案中合理的是 . a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收 (3)过二硫酸钾(K2S2O8)具有强氧化性.可将I-氧化为I2: S2O+2I- 2SO+I2 通过改变反应途径.Fe3+.Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程: . . (4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3.FeO.SiO2.Al2O3)可制备Fe2O3.方法为: ①用稀盐酸浸取炉渣.过滤. ②滤液先氧化.再加入过量NaOH溶液.过滤.将沉淀洗涤.干燥.煅烧得Fe2O3. 据以上信息回答下列问题: a.除去Al3+的离子方程式是 b.选用提供的试剂.设计实验验证炉渣中含有FeO. 提供的试剂:稀盐酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水 所选试剂为 . 证明炉渣中含有FeO的实验现象为 .
网址:http://m.1010jiajiao.com/timu3_id_59815[举报]
黄铜矿![]() 是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为
![]()
![]()
![]()
若![]() 中
中![]() 的化合价为
的化合价为![]() ,反应中被还原的元素是 (填元素符号)。
,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程产生大量![]() 。下列处理方案中合理的是 (填代号)。
。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制![]() d.用浓硫酸吸收
d.用浓硫酸吸收
(3)过二硫酸钾![]() 具有强氧化性,可将
具有强氧化性,可将![]() 氧化为
氧化为![]() :
:
![]()
通过改变反应途径,![]() 、
、![]() 均可催化上述反应。试用离子方程式表示
均可催化上述反应。试用离子方程式表示![]()
对上述反应催化的过程 、 。(不必配平)
查看习题详情和答案>>(2008?山东)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2.
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程:
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
查看习题详情和答案>>
(1)冶炼铜的反应为:
8CuFeS2+21O2
| ||
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
Cu、O
Cu、O
(填元素符号).(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是
b、c
b、c
(填代号).a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2.
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程:
2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
、S2O82-+2Fe2+=2SO42-+2Fe3+
S2O82-+2Fe2+=2SO42-+2Fe3+
(不必配平)(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是
2Al3++4OH-=AlO2-+2H2O
2Al3++4OH-=AlO2-+2H2O
.b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
稀硫酸、KMnO4溶液
稀硫酸、KMnO4溶液
.证明炉渣中含有FeO的实验现象为稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
.(2011?南京一模)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之,还可以制备硫以及铁的化合物.
(1)近年来,湿法炼钢有了新进展.某工厂以一种叫Thibacillus ferroxidans的细菌为基体生产 铜和绿矾的工艺流程如下:
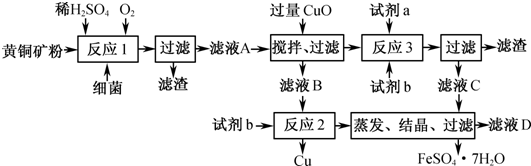
(1)试剂a为
(2)反应l的化学方程式为
(Ⅱ)以CuFeS2精矿为原料在沸腾炉中和02(空气)反应,生成物冷却后经溶解、除铁、结晶.得到 CuS04?5H2O.沸腾炉的温度与生成物主要成分的水溶性和酸溶性实验结果如图.
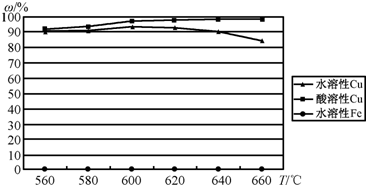
(1)沸腾炉生成物中的含铁物质主要成分为
(2)为获得最高的水溶性Cu(%),沸腾炉的温度应控制在
查看习题详情和答案>>
(1)近年来,湿法炼钢有了新进展.某工厂以一种叫Thibacillus ferroxidans的细菌为基体生产 铜和绿矾的工艺流程如下:

(1)试剂a为
稀硫酸
稀硫酸
,试剂b为铁粉
铁粉
.(写名称)(2)反应l的化学方程式为
4CuFeS2+2H2SO4+17O2
4CuSO4+2Fe2(SO4)3+2H2O
| ||
4CuFeS2+2H2SO4+17O2
4CuSO4+2Fe2(SO4)3+2H2O
| ||
(Ⅱ)以CuFeS2精矿为原料在沸腾炉中和02(空气)反应,生成物冷却后经溶解、除铁、结晶.得到 CuS04?5H2O.沸腾炉的温度与生成物主要成分的水溶性和酸溶性实验结果如图.

(1)沸腾炉生成物中的含铁物质主要成分为
铁的氧化物
铁的氧化物
.(2)为获得最高的水溶性Cu(%),沸腾炉的温度应控制在
600
600
℃左右,高于该温度生成物中的水溶性 Cu(%)下降,可能原因是硫酸铜受热分解
硫酸铜受热分解
.黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物,在高温下发生8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2反应,则下列说法正确的是( )
| ||
| A、黄铜矿只失电子,作还原剂 |
| B、若上述反应转移10 mol电子,参加反应的CuFeS2为73.6克 |
| C、1 mol CuFeS2参加反应,生成还原产物也是1 mol |
| D、氧化产物与还原产物物质的量之比为3:5 |
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫、铁的化合物.
(1)黄铜矿的组成元素中,属于副族元素的是
(2)冶炼铜的反应为8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应的催化过程.
查看习题详情和答案>>
(1)黄铜矿的组成元素中,属于副族元素的是
铜
铜
(填写名称,下同);属于主族元素的是硫
硫
,它位于周期表的位置是第三周期ⅥA主族
第三周期ⅥA主族
,它的原子半径>
>
Cl的原子半径(填“>”、“<”或“=”,下同),它的气态氢化物的稳定性<
<
HCl.(2)冶炼铜的反应为8CuFeS2+21O2
| ||
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
Cu、O
Cu、O
(填元素符号),氧化产物是Fe2O3、SO2
Fe2O3、SO2
(填化学式).(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应的催化过程.
2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
、S2O82-+2Fe2+=2SO42-+2Fe3+
S2O82-+2Fe2+=2SO42-+2Fe3+
(请配平).