网址:http://m.1010jiajiao.com/timu3_id_59599[举报]
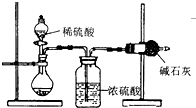 测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:
测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:I.吸收法
如图所示:
(1)根据实验装置图分析,在每次实验过程中所进行的称量操作至少要进行
(2)若重复测定了三次,得到Na2CO3的质量分数的数据存在较大的偏差,产生偏差的原因可能是
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.用了稀硫酸与样品反应
C.加入稀硫酸的量不足,则可能造成误差
D.反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收
除上述原因外,从装置看还有一个重要原因是
II.滴定法
称取样品m g,配制成500mL溶液.从中取出25mL加入足量的BaCl2溶液振荡,滴加2~3滴酚酞,用a mol/L标准盐酸滴定,至终点时消耗盐酸v mL.
(1)该同学加入足量的BaCl2溶液后未将BaCO3过滤就滴定,有人认为在滴定中BaCO3会转化为Ba(HCO3)2,消耗盐酸.你认为要过滤吗?
(2)判断滴定终点到达的依据是
Ⅲ.沉淀法
称取样品m g,并溶解加过量Ba(NO3)2溶液,过滤、洗涤、烘干,称量得固体n g.
(1)混合物中碳酸钠的质量分数为(用m、n表示)
| 106n |
| 197m |
| 106n |
| 197m |
(2)洗涤沉淀的操作要点是
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用Ba(NO3)2溶液而不用Ca(NO3)2溶液的原因是
随着流感季节的到来和N1H1的威胁,疫苗的需求空前高涨。尽管那些疫苗是有效的,但美国密苏里州大学研究人员于2009年12月研究发现,一些非处方药,如阿司匹林等抑制某些酶的药物会影响疫苗的效果。用丙酮为主要原料合成长效缓释阿司匹林的流程如下图。

回答下列问题:
Ⅰ.(1)上述合成C的路线曾用作有机玻璃单体(![]() )合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得
)合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得![]() ,其化学方程式为: 。
,其化学方程式为: 。
如此改进的优点为: 。
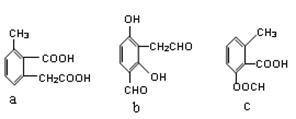
(2)阿司匹林的结构简式为 ,下列物质与阿司匹林互为同分异构体的有 (填字母)。

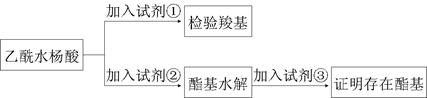
Ⅱ.某研究性学习小组看了市售阿司匹林的药品说明书,为了验证乙酰水杨酸的官能团和测定阿司匹林的纯度(假设杂质不参加反应),进行了下列实验探究:
(1)阿司匹林有效成分中羧基和酯基官能团的验证

试剂①是________,现象为_________;该方案通过检验乙酰水杨酸水解生成的____________,并通过分析间接验证酯基的存在。
(2)准确称取阿司匹林a g,粉碎并装入锥形瓶,加水溶解,加入标准浓度C1mol/L的氢氧化钠溶液V1mL,煮沸片刻,使其充分反应。冷却后,用酚酞作指示剂,用C2mol/L盐酸滴定,滴定前盐酸体积为V2mL,滴定终点时盐酸体积为V3mL。(已知:滴定反应是,NaOH+HCl=NaCl+H2O,乙酰水杨酸的相对分子质量为180)
①根据上述数据计算该阿司匹林的纯度为 。
②滴定终点判断“标准”是 ;操作过程中在锥形瓶底垫一张白纸,其作用是 。
③下列操作一定会导致测定结果偏高的是 (填字母)。
A.装盐酸前,滴定管未用标准溶液润洗
B.测定盐酸体积时开始仰视读数,最后俯视读数
C.锥形瓶用标准氢氧化钠溶液润洗
D.滴定过程中盐酸溅到瓶外
E.称量样品时,砝码在左边,而样品放在右边
F.用甲基橙代替酚酞作指示剂
查看习题详情和答案>>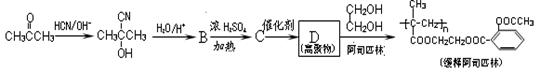
回答下列问题:
Ⅰ.(1)上述合成C的路线曾用作有机玻璃单体(
 )合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得
)合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得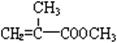 ,其化学方程式为: 。
,其化学方程式为: 。如此改进的优点为: 。
(2)阿司匹林的结构简式为 ,下列物质与阿司匹林互为同分异构体的有 (填字母)。
Ⅱ.某研究性学习小组看了市售阿司匹林的药品说明书,为了验证乙酰水杨酸的官能团和测定阿司匹林的纯度(假设杂质不参加反应),进行了下列实验探究:
(1)阿司匹林有效成分中羧基和酯基官能团的验证
试剂①是________,现象为_________;该方案通过检验乙酰水杨酸水解生成的____________,并通过分析间接验证酯基的存在。
(2)准确称取阿司匹林a g,粉碎并装入锥形瓶,加水溶解,加入标准浓度C1mol/L的氢氧化钠溶液V1mL,煮沸片刻,使其充分反应。冷却后,用酚酞作指示剂,用C2mol/L盐酸滴定,滴定前盐酸体积为V2mL,滴定终点时盐酸体积为V3mL。(已知:滴定反应是,NaOH+HCl=NaCl+H2O,乙酰水杨酸的相对分子质量为180)
①根据上述数据计算该阿司匹林的纯度为 。
②滴定终点判断“标准”是 ;操作过程中在锥形瓶底垫一张白纸,其作用是 。
③下列操作一定会导致测定结果偏高的是 (填字母)。
| A.装盐酸前,滴定管未用标准溶液润洗 |
| B.测定盐酸体积时开始仰视读数,最后俯视读数 |
| C.锥形瓶用标准氢氧化钠溶液润洗 |
| D.滴定过程中盐酸溅到瓶外 |
F.用甲基橙代替酚酞作指示剂
 (2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
(2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
请回答下列问题:
(1)反应①中生成的无色气体A是
(2)经测定NH4HCO3溶液呈中性,请分析原因(用离子方程式和文字表述说明理由)
 NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-NH4+和HCO3-的水解程度基本相同
 NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-NH4+和HCO3-的水解程度基本相同
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净
(4)温度和NH4HCO3浓度会影响反应①的速率.现设计如下实验方案探究温度和NH4HCO3浓
度对反应①速率的影响.请在表格空白处填写适当的反应条件.
| 实验编号 | 实验目的 | 温度 | c(NH4HCO3) |
| I | 为以下实验作参照 | 60℃ | c1 |
| II | 探究浓度对反应①速率的影响 | c2 | |
| III | 探究温度对反应①速率的影响 | 80℃ |
请分析t2℃时,滤液①中溶质的质量分数下降的原因是
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |