摘要:10.KMnO4溶液 工作原理是:当打开自来水龙头.装置内部的空气随自来水被带走.导致装置内部压强减小.使过滤速度加快.得到较干燥的固体物质. (3)取滤液C.加入HNO3和AgNO3溶液.若观察到白色沉淀产生.即可证明火柴头中含有氯元素. (4)ClO3¯+3NO2¯+Ag+=AgCl↓+3NO3¯ AgNO2与AgCl均为不溶于水的白色沉淀. (6)2KClO3 2KCl+3O2↑ S+O2SO2 11..答案Na2O2与H2O反应生成O2,该反应放热. (2)2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑ (3)Cu + 4H++ 2NO3- =Cu2++2NO2↑+2H2O (4)小试管中溶液变蓝(绿),试管中出现红棕色气体, (5)减少气体对空气的污染 (6)氢氧化钠固体 .浓氨水 12.无影响 偏低
网址:http://m.1010jiajiao.com/timu3_id_58727[举报]
某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了如图1实验流程图: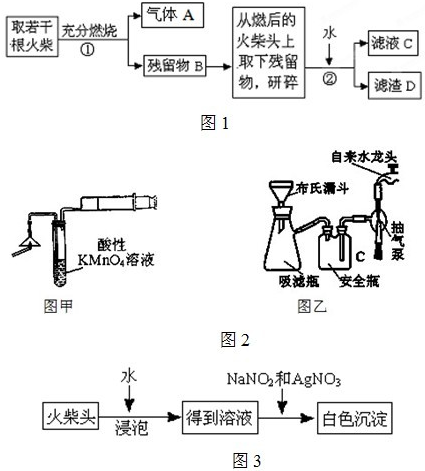
请回答以下问题:
(1)为验证气体A,按图2甲所示进行实验:若能观察到
(2)步骤②的实验操作装置如上图2乙所示,该操作的名称是
(3)要证明火柴头中含有Cl元素的后续实验步骤是
(4)有学生提出检验火柴头上KClO3另一套实验方案图3:有关的离子反应方程式为
(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验.
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验
(6)写出步骤①中发生反应的化学方程式
查看习题详情和答案>>

请回答以下问题:
(1)为验证气体A,按图2甲所示进行实验:若能观察到
KMnO4溶液(紫红色)褪色
KMnO4溶液(紫红色)褪色
的现象,即可证明火柴头上含有S元素.(2)步骤②的实验操作装置如上图2乙所示,该操作的名称是
减压过滤(或抽滤)
减压过滤(或抽滤)
,其工作原理是其工作原理是当打开自来水龙头时,装置内部的空气随自来水被带走,导致装置内部产生负压,从而加快过滤速度,得到较干燥的固体物质
其工作原理是当打开自来水龙头时,装置内部的空气随自来水被带走,导致装置内部产生负压,从而加快过滤速度,得到较干燥的固体物质
.(3)要证明火柴头中含有Cl元素的后续实验步骤是
取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素
取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素
.(4)有学生提出检验火柴头上KClO3另一套实验方案图3:有关的离子反应方程式为
ClO3-+3NO2-+Ag+=AgCl↓+3NO3-
ClO3-+3NO2-+Ag+=AgCl↓+3NO3-
.(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验.
| 实验次数 | H2O2溶液质量分数% | H2O2溶液用量/毫升 | 物质D用量/克 | 反应温度/℃ | 收集气体体积/毫升 | 所需时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
②
②
和③
③
证明物质D的用量越大,反应速率越快.(6)写出步骤①中发生反应的化学方程式
2KClO3
2KCl+3O2↑,S+O2
SO2
| ||
| △ |
| ||
2KClO3
2KCl+3O2↑,S+O2
SO2
.
| ||
| △ |
| ||