网址:http://m.1010jiajiao.com/timu3_id_57838[举报]
(1)合成氨反应,在2L密闭容器中通入2mol的N2和6mol的H2,5min时反应达到平衡,此时容器内的压强变为原来的3/4,0-5min该反应的化学反应速率为V(H2)=
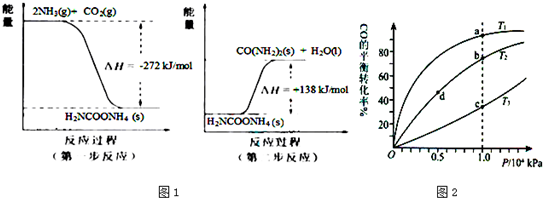
(2)NH3 (g)与CO2(g)经过两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图1:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
(3)用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c)
C.平衡常数:K(b)=K(d)
D.正反应速率:v(b)>v(d)
E.平均摩尔质量:M(a)=M(c)
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),则溶液显(
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
(1)合成氨反应,在2L密闭容器中通入2mol的N2和6mol的H2,5min时反应达到平衡,此时容器内的压强变为原来的3/4,0-5min该反应的化学反应速率为V(H2)=______,N2的转化率=______,化学平衡常数K=______.
(2)NH3 (g)与CO2(g)经过两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图1:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为______.
(3)用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是______(填字母)
A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c)
C.平衡常数:K(b)=K(d)
D.正反应速率:v(b)>v(d)
E.平均摩尔质量:M(a)=M(c)
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl¯),则溶液显(______)性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=______.

查看习题详情和答案>>
(16分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H22NH3 。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
查看习题详情和答案>>
(16分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3。
2NH3。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
(16分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3 。
2NH3 。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。

③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
查看习题详情和答案>>