摘要:20.已知0.25molCH4完全燃烧生成液态水时放出222.5kJ 热量.则下列热化学方程式中正确 的是 ( ) A.CH4(g)+O2(g)= CO2(g)+H2O(1); △H=-445kJ/mol B.CH4(g)+2O2(g)=CO2(g)+2H2O(1); △H=+890kJ/mol k+s-5#u C.CH4(g)+2O2(g)=CO2(g)+2H2O(g); △H=-890kJ/mol D.CH4(g)+2O2(g)=CO2(g)+2H2O(g); △H=+890kJ/mol
网址:http://m.1010jiajiao.com/timu3_id_56700[举报]
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出QKJ的热量.
(1)反应的热化学方程式为
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
(3)在西部大开发的十大工和中,”西气东输是其中之一.“西气东输”中的”气”是指
A.水煤气 B.裂解气 C.天然气 D.电石气
(4)2001年2月24日,中央电视台报道:近年来北京的空气质量提高,已石家庄Ⅱ级标准.这主要得力于搬迁一此气超标排放的工厂和大量使用燃气燃料,减少了SO2和粉尘的排放,特别是使用了许多的环保型汽车,排放污染值大大降低.已知1g甲烷完全燃烧生成气态水时放出热量50.125KJ.试写出甲烷燃烧的热化学方程式
查看习题详情和答案>>
(1)反应的热化学方程式为
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-2.5QkJ?mol-1
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-2.5QkJ?mol-1
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
生成物为氮气和水,不污染空气
生成物为氮气和水,不污染空气
(3)在西部大开发的十大工和中,”西气东输是其中之一.“西气东输”中的”气”是指
C
C
A.水煤气 B.裂解气 C.天然气 D.电石气
(4)2001年2月24日,中央电视台报道:近年来北京的空气质量提高,已石家庄Ⅱ级标准.这主要得力于搬迁一此气超标排放的工厂和大量使用燃气燃料,减少了SO2和粉尘的排放,特别是使用了许多的环保型汽车,排放污染值大大降低.已知1g甲烷完全燃烧生成气态水时放出热量50.125KJ.试写出甲烷燃烧的热化学方程式
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802KJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802KJ/mol
.
Ⅰ氮元素的化合物在现在以及将来有着广阔的发展前景
(1)氮化铝具有耐高温,抗冲击等优良性能,可以通过氧化铝、氮气和碳在高温下反应制得,缺点是会生成一种有毒气体,写出反应方程式: ,上述反应,每生成2mol氮化铝,N2得到 mol电子.
(2)C3N4晶体的硬度可以和金刚石相媲美,且原子间均以单键结合,C3N4属于晶体,晶体中C-N键键长 金刚石中的C-C键键长(填“大于”、“小于”或“等于”).
(3)氮化硅是一种高温陶瓷材料,用来制作汽轮机叶子或永久性模具,现利用四氯化硅和氮气在氢气的作用下加强热,可得较高纯度的氮化硅,反应的化学方程式为: ,氮化硅抗腐蚀性强,但是易被氢氟酸腐蚀,写出相关的方程式 .
(4)氮的另外一种化合物肼(N2H4)是一种火箭发射原料,已知0.4mol液态肼与足量液态双氧水发生反应生成N2和水蒸气,放出256.65kJ的热量.请写出该反应的热化学方程式: .利用肼、氧气与KOH溶液可组成碱性燃料电池,肼分子(N2H4)可以在氧气中燃烧生成氮气和水.则该电池反应的负极反应式为: ;电池工作时,电解质溶液中的OH-离子向 极移动.
Ⅱ用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用.例如:
(1)目前应用最多的太阳能电池的光电转化材料是 ;
(2)光导纤维的主要成分是:
(3)用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类称为 的化合物.
查看习题详情和答案>>
(1)氮化铝具有耐高温,抗冲击等优良性能,可以通过氧化铝、氮气和碳在高温下反应制得,缺点是会生成一种有毒气体,写出反应方程式:
(2)C3N4晶体的硬度可以和金刚石相媲美,且原子间均以单键结合,C3N4属于晶体,晶体中C-N键键长
(3)氮化硅是一种高温陶瓷材料,用来制作汽轮机叶子或永久性模具,现利用四氯化硅和氮气在氢气的作用下加强热,可得较高纯度的氮化硅,反应的化学方程式为:
(4)氮的另外一种化合物肼(N2H4)是一种火箭发射原料,已知0.4mol液态肼与足量液态双氧水发生反应生成N2和水蒸气,放出256.65kJ的热量.请写出该反应的热化学方程式:
Ⅱ用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用.例如:
(1)目前应用最多的太阳能电池的光电转化材料是
(2)光导纤维的主要成分是:
(3)用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类称为
为探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率,甲同学设计了如图装置(图中部分夹持仪器已略去).已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2.
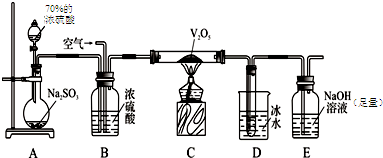
(1)开始进行实验时,首先应进行的操作是 .停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 .
(2)已知0.5mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为 .
(3)实验结束后,若装置D增加的质量为a g,装置E增加的质量为b g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示).
(4)为探究反应后E中的可能生成物,同学们提出了几种假设:
假设1:只有亚硫酸钠;
假设2:只有硫酸钠;
假设3: .
乙同学通过实验证明了假设3成立.请帮助乙同学完成实验操作和现象 .
查看习题详情和答案>>

(1)开始进行实验时,首先应进行的操作是
(2)已知0.5mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
(3)实验结束后,若装置D增加的质量为a g,装置E增加的质量为b g,则此条件下二氧化硫的转化率是
(4)为探究反应后E中的可能生成物,同学们提出了几种假设:
假设1:只有亚硫酸钠;
假设2:只有硫酸钠;
假设3:
乙同学通过实验证明了假设3成立.请帮助乙同学完成实验操作和现象
(1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
)+c(NH3?H2O)一定等于
②溶液中n(OH-)+n(Cl-)-n(NH+4)=
查看习题详情和答案>>
C(Na+)>C(CN-)>C(OH-)>C(H+)
C(Na+)>C(CN-)>C(OH-)>C(H+)
.(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
+ 4 |
0.02mol/L
0.02mol/L
②溶液中n(OH-)+n(Cl-)-n(NH+4)=
n(Na+)+n(H+)
n(Na+)+n(H+)
.