摘要:8.Ⅰ.盐酸.硫酸和硝酸是中学阶段常见的“三大酸 .请就“三大酸 与金属铜反应的情况.同答下列问题: (1)我们知道.稀盐酸与铜不反应.但向稀盐酸中加入后.则可使铜溶解.该反应的离子方程式为 . 某同学未加入氧化剂.而是将它设计成一个电解 装置.也能使铜很快溶于稀盐酸.请在方格中画 出该装置: (2)在一定体积的18 mol·L的浓硫酸中加入过量的铜片.加热使之反直.被还原的硫酸是0.9mol.则该硫酸的实际体积 (填“大于 .“等于 或“小于 )100mL.有同学提出:若使剩余的铜片继续溶解.可向其中加入硝酸盐.可行吗? . Ⅱ.某化学小组欲探究铁及其忱合物的氧化性和还原性.请回答下列问题: 试剂:铁粉.溶液..溶液.氯水.锌片.铜片.溶液. (1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是 . (2)实验记录: 序号 实验内容 实验现象 离子方程式 实验结论 ① 在溶液中滴入适量氯水 溶液由浅绿色变为棕黄色 具有还原性 ② 在溶液中加入锌片 ③ 在溶液中加入足量铁粉 具有氧化性 具有还原性 ④ 具有氧化性 实验结论:只有还原性.只有氧化性.既有氧化性.又有还原性. (3)亚铁盐在溶液中易被氧化.而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化 . 并简述的检验的方法 .
网址:http://m.1010jiajiao.com/timu3_id_54685[举报]
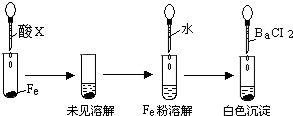 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为:
Cu+H2O2+2HCl=2H2O+CuCl2
Cu+H2O2+2HCl=2H2O+CuCl2
.(2)在一定体积的10mol?L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积
大于
大于
(填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
.(3)根据下图操作及现象推断酸X为
b
b
(填序号).a、浓盐酸 b、浓硫酸 c、浓硝酸.
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为:
(2)在一定体积的10mol?l-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积
(3)根据下图操作及现象推断酸X为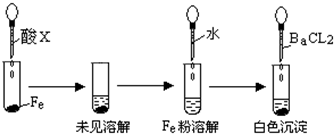
a、浓盐酸 b、浓硫酸 c、浓硝酸.
查看习题详情和答案>>
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为:
Cu+H2O2+2HCl=CuCl2+2H2O
Cu+H2O2+2HCl=CuCl2+2H2O
.(2)在一定体积的10mol?l-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积
大于
大于
(填“大于”、“等于”或“小于”)100ml.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(3)根据下图操作及现象推断酸X为
b
b
(填序号).
a、浓盐酸 b、浓硫酸 c、浓硝酸.
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”,请就“三大酸”的性质,回答下列问题:
(1)稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为
(2)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO.其实验流程图如下:
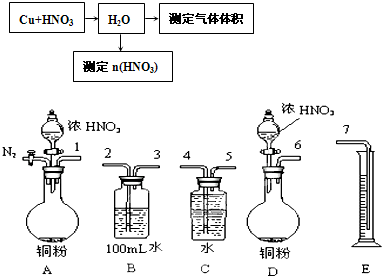
①若要测定NO的体积,从图所示的装置中,你认为应选用
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
(3)工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2=8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,需要空气的体积(标准状况)为
查看习题详情和答案>>
(1)稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为
Cu+H2O2+2HCl═CuCl2+2H2O
Cu+H2O2+2HCl═CuCl2+2H2O
.(2)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO.其实验流程图如下:

①若要测定NO的体积,从图所示的装置中,你认为应选用
A
A
装置进行Cu与浓硝酸反应实验,选用的理由是因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化
因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化
.②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
123547
123547
(填各导管口编号).123547
123547
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
升高
升高
(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平.(3)工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2=8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,需要空气的体积(标准状况)为
1.68×107
1.68×107
L.盐酸、硫酸和硝酸是中学阶段常见的“三大酸”,请就“三大酸”的性质,回答下列问题:
⑴稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为________________________________________________________。
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
⑵某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
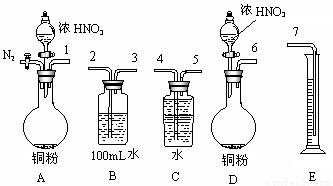
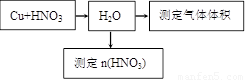 |
①若要测定NO的体积,从上图所示的装置中,你认为应选用 装置进行Cu与浓硝酸反应实验,选用的理由是 。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3 ,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,需要空气的体积(标准状况)为 L。
查看习题详情和答案>>

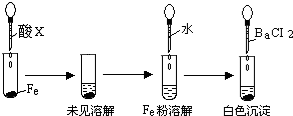 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题: