摘要:10.( 湖北黄石二中09高三化学检测)下列实验的的失败原因是因为缺少必要的实验步骤造成的是 ①将乙醇和乙酸混合.再加入稀硫酸共热制乙酸乙酯 ②实验室用无水乙醇和浓硫酸共热到140℃制乙烯 ③验证某RX是碘代烷.把RX与烧碱水溶液混合加热后.将溶液冷却后再加入硝酸银溶液出现褐色沉淀 ④做醛的还原性实验时.当加入新制的氢氧化铜悬浊液后.未出现红色沉淀 ⑤检验淀粉已经水解.将淀粉与少量稀硫酸加热一段时间后.加入银氨溶液后未析出银镜 A.①④⑤ B.①③④⑤ C.③④⑤ D.④⑤
网址:http://m.1010jiajiao.com/timu3_id_53876[举报]
三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3?6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3?6H2O晶体.填写下列空白:
(1)收集导管B处的气体可采用的方法是
(2)烧杯内放过量稀HNO3的原因是
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O,而不用直接蒸干的方法来制得晶体的理由是
(5)你认为该实验存在的缺点可能有:
查看习题详情和答案>>

(1)收集导管B处的气体可采用的方法是
用排水法或向下排空气法
用排水法或向下排空气法
.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是因废铁屑中含少量Cu等杂质,形成Fe-Cu原电池使反应速率加快
因废铁屑中含少量Cu等杂质,形成Fe-Cu原电池使反应速率加快
.(2)烧杯内放过量稀HNO3的原因是
稀HNO3有强氧化性,为保证使Fe2+ 全部氧化成Fe3+
稀HNO3有强氧化性,为保证使Fe2+ 全部氧化成Fe3+
.发生反应的离子方程式是3 Fe2++4H++NO3-═3 Fe3++NO↑+2H2O
3 Fe2++4H++NO3-═3 Fe3++NO↑+2H2O
.(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是
与大气相通,使分液漏斗中的酸可滴入A中
与大气相通,使分液漏斗中的酸可滴入A中
.(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O,而不用直接蒸干的方法来制得晶体的理由是
因为FeCl3是强酸弱碱盐水解:FeCl3+3H2O?Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3?6H2O
因为FeCl3是强酸弱碱盐水解:FeCl3+3H2O?Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3?6H2O
(5)你认为该实验存在的缺点可能有:
反应中产生的有害气体会污染环境;用稀HNO3氧化FeCl2时会有Fe(NO3)3生成而使制得的FeCl3?6H2O不纯
反应中产生的有害气体会污染环境;用稀HNO3氧化FeCl2时会有Fe(NO3)3生成而使制得的FeCl3?6H2O不纯
. (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO
| ||
8
8
mol;(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
因酸性废液中,将会Fe3+抑制的水解,无法得到Fe(OH)3胶体,故不能够吸附悬
因酸性废液中,将会Fe3+抑制的水解,无法得到Fe(OH)3胶体,故不能够吸附悬
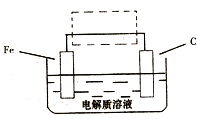
;(3)钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向


(4)硫酸亚铁晶体(FeS04?7H20)常作医药上的补血剂.课外研究性小组测定该补血剂中铁元素的含量.实验步骤如下:
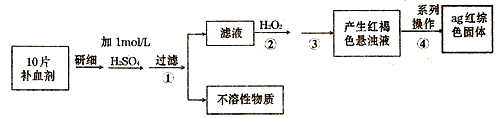
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加H2O2,此过程的现象为:
H2O2溶液由浅绿色变为血红色
H2O2溶液由浅绿色变为血红色
;②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH=
3.3
3.3
(已知溶液中离子浓度小于10-5mol时,该离子可看做沉淀完全;lg2=0.3);③步骤④中一系列的操作步骤为:过滤、
洗涤
洗涤
、灼烧、冷却、称量;④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质量为
0.07a
0.07a
g.(用含a的式子表示)全世界每年因生锈损失的钢铁约占世界钢铁年产量的
.某学生想探究铁生锈的条件,他将干净的铁钉分别同时入放A、B、C三支试管中进行研究.
(1)请你帮助该学生完成下列实验设计的内容:
(2)一周后,编号为
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是
查看习题详情和答案>>
| 1 |
| 4 |
(1)请你帮助该学生完成下列实验设计的内容:
| 编号 | 操作方法 | 实验目的 |
| A | 向干燥试管A中放入干燥的铁钉,并用橡皮塞塞上 向干燥试管A中放入干燥的铁钉,并用橡皮塞塞上 |
探究铁在干燥空气中的生锈情况 |
| B | 放入铁钉,注入蒸馏水浸没铁钉,并用植物油液封 | 探究铁钉在水中的生锈情况 探究铁钉在水中的生锈情况 |
| C | 将铁钉放入试管C中,加入蒸馏水浸没铁钉一半,敞口放置 将铁钉放入试管C中,加入蒸馏水浸没铁钉一半,敞口放置 |
探究铁在有空气和水封时的生锈情况 |
C
C
的试管中的铁钉最易生锈.证明铁生锈的条件的条件是在有水和氧气时铁最易生锈
在有水和氧气时铁最易生锈
.(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是
南方雨水多,空气中水汽含量高,所以铁更容易生锈
南方雨水多,空气中水汽含量高,所以铁更容易生锈
.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下
1反应速率最大的(即0~1、l~2、2~3、3~4、4~5min)时间段为
②反应速率最小的时间段为
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就分别采取下列措施以减慢反应速率
A.事先在硫酸溶液中加入等体积的蒸馏水
B.将锌粒换成等质量的锌粉
C.事先在硫酸溶液中加入等体积的NaCl溶液
你认为他的做法可行的是
查看习题详情和答案>>
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
2~3min
2~3min
.原因是因该反应是放热反应,此时温度高
因该反应是放热反应,此时温度高
②反应速率最小的时间段为
4~5min
4~5min
,原因是因为此时H+浓度小
因为此时H+浓度小
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就分别采取下列措施以减慢反应速率
A.事先在硫酸溶液中加入等体积的蒸馏水
B.将锌粒换成等质量的锌粉
C.事先在硫酸溶液中加入等体积的NaCl溶液
你认为他的做法可行的是
A、C
A、C
(填相应字母);做法不可行的理由是将锌粒换成等质量的锌粉,增大了反应的接触面积,化学反应速率加快
将锌粒换成等质量的锌粉,增大了反应的接触面积,化学反应速率加快
.