网址:http://m.1010jiajiao.com/timu3_id_51255[举报]
氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
(1)用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2(g)+3H2(g) ![]() 2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。
2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。
①请写出该反应的热化学方程式 。常温下,将10mol N2和30mol H2放入合成塔中,放出的热量 (填“大于”或“大于”或“小于”)924 kJ
②如果一个反应的△H-T△S<0,则该反应能够自发进行。已知该反应的△S=-198.2J?K-1?mol-1。请判断上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。(2)Marnellos和Stoukides发明了电化学制备氨气方法,该方法用SCY陶瓷将阳极和阴极隔开,SCY陶瓷具有高质子导电性,其作用是传递H这种方法实现了高温常压下高转化率的电化学合成氨。已知阳极发生的电极反应为:H2→2H++2e-。则阴极的电极反应为 。
查看习题详情和答案>>在氨的工业合成中,有三个关键的技术问题,请结合所学知识解决它们。
(1)合成氨的化学原理是N2+3H2??2NH3,在工业上选择20~50 MPa的较高压强和450 ℃左右的温度来进行反应,请结合有关的化学原理解释。
(2)在生产过程中需要大量氢气,现有以下几种获得氢气的方法,请你选出最适宜的,并说明理由。
A.电解水制取氢气
B.由煤或焦炭来制取氢气:煤或焦炭经加热,炽热的炭与水蒸气反应生成氢气
C.由天然气或重油制取氢气:天然气的主要成分甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳;一氧化碳在催化剂存在的条件下与水蒸气反应得到氢气和二氧化碳
(3)合成氨的生产工艺流程:首先用适当的方法生产出合成氨的原料气——氮气和氢气。氮气和氢气的混合气体在合成塔中于一定条件下,通过催化剂的作用产生氨气,再通过氨分离器不断地把生成的氨分离出来,同时未转化的反应气体再进入合成塔循环加工。这就是合成氨的工艺流程。请根据这一描述过程画出流程方框图。
查看习题详情和答案>>
在氨的工业合成中,有三个关键的技术问题,请结合所学知识解决它们:
(1)合成氨的化学原理是N2+3H2 ![]() 2NH3,在工业上选择20―50MPa的较高压强和 500
2NH3,在工业上选择20―50MPa的较高压强和 500![]() 的温度来进行反应,请结合有关的化学原理解释。
的温度来进行反应,请结合有关的化学原理解释。
(2)在生产过程中需要大量氢气,现有以下几种获得氢气的方法,请你选出最适宜的,并说明理由。
A.电解水制取氢气;B.由煤或焦碳来制取氢气:煤或焦碳经加热,炽热的炭与水蒸气反应生成氢气;C.由天然气或重油制取氢气:天然气的主要成分甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳,一氧化碳在催化剂存在的条件下与水蒸气反应得到氢气和二氧化碳。
(3)合成氨的生产工艺流程:首先用适当的方法生产出合成氨的原料气一一氮气和氢气。
氮气和氢气的混合气体在合成塔一定条件下,通过催化扭l的作用产生氨气,再通过氮分离器不断地把生成的氨分离出来,同时未转化的反应气体再进入合成塔循环加工。这就是合成氨的工艺流程。请根据这一描述过程画出流程方框图。
查看习题详情和答案>>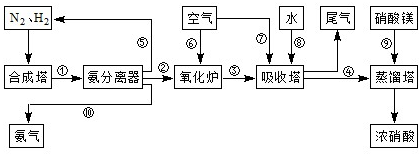
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中
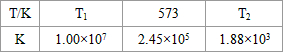
T1
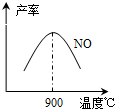 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因(4)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)=
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石-鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
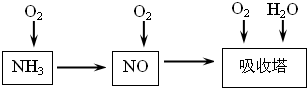
(1)已知反应一经发生,铂铑合金网就会处于红热状态.写出氨催化氧化的化学方程式:
| ||
| △ |
| ||
| △ |
(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=a kJ?mol-1
N2(g)+2O2(g)=2NO2(g)△H=b kJ?mol-1
H2O(l)=H2O(g)△H=c kJ?mol-1
则反应2NO2(g)+4H2(g)=N2(g)+4H2O(l)的△H=
(3)①氨气是制取硝酸的重要原料,合成氨反应的化学方程式为N2+3H2
| ||
| 高温高压 |
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.3v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.1mol N≡N键断裂,同时1mol H-H键断裂
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L的固定容积的密闭容器中,5min后反应达平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,则反应速率v(N2)=