摘要:3. 例题精讲 例1今有A.B.C.D.E五种短周期元素.它们的核电荷按 C.A.D.E的顺序增大.C.D都能分别与A按原子个数比1:1或2:1形成化合物.CB可与EA2反应生成C2A与气态物质EB4. ⑴写出五种元素名称A B ,C .D , E . ⑵画出E的原子结构简图 .写出电子式D2A2 , EB4 . ⑶比较EA2与EB4的熔点高低 < . ⑷写出D单质与CuSO4溶液反应的离子方程 . [解析]此题的关键在于分析EB4中E元素只能是ⅣA族元素C或Si.因B 的原子序数不最小.则B不可能为H元素.E的价态应为+4.B应为ⅦA族元素.且只能为F.如果无Cl元素.则原子序数比E还大.而E只能为Si.即EB4为SiF4, 从CB的化合物的形式可知C为+1价.则由C2A可知A为-2价.只能为O.能与O按原子个数比1:1或2:1形成化合物的元素只能是H或Na. [答案]⑴氧.氟.氢.钠.硅 ⑵ 略 ⑶ SiO2 >SiF4 ⑷ 2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑ [命题意图]本题考查主族元素的化合价与原子序数的关系.以及有关元素周期表中各关系式的具体应用. 例2砹(At)是原子序数最大的卤族元素.推测砹或砹的化合物不可能具有的性质是 A. HAt很稳定 B. 易溶于某些有机溶剂 C. AgAt不溶于水 D. 是有色固体 [解析]由题意.砹在周期表中与碘相邻.故它的性质与碘具有相似性.但它的非金属性应比碘弱.HAt的稳定不如HI.故选项A错误,碘易溶于某些有机溶剂.则砹也应溶解,AgI不溶于水.则AgAt也不溶于水,碘是紫黑色固体.根据相似性砹也是有色固体. 本题正确选项为A. 例3:两种短周期的元素X和Y.可组成化合物XY3.当Y的原子序数为m时.X的原子序数可能是哪些? m+8,m+6. 在解题中应首先根据抽象化学式XY3确定X.Y可能的化合价 XY3或XY3.依据X.Y可能的化合价找到它们在周期表中的位置 X位于ⅢA族或ⅤA.Y位于ⅦA或ⅠA.再根据它们在周期表中位置推断出具体元素进行组合.这样从抽象的化学式XY3落实到具体实例:BF3.AlF3.BCl3.AlCl3.NH3.PH3.此时要注意思维的严谨性.记住特殊实例:PCl3.SO3.最后再用具体实例代替抽象的XY3.逐一进行核对得出X可能的原子序数.以上答案均可能. 此类型题的特点主要集中在短周期元素的范围内进行讨论.有时还强调属于离子型或共价型化合物.主要考查思维的敏捷性和全面性.短周期元素两两形成化合物的类型与实例归纳如下: 类型 AB AB2 A2B AB3 A2B3 A3B2 离子型 ⅠA与ⅦA ⅡA与ⅦA ⅠA与ⅥA ⅢA与ⅦA ⅢA与ⅥA ⅡA与ⅤA 共价型 H与ⅦA ⅣA与ⅥA H与ⅥA H与ⅤA B与ⅥA 特例 CO.NO SO2.NO2 N2O PCl3.SO3 N2O3 例4:X.Y是除第一周期外的短周期元素.它们可以形成离子化合物XmYn.且离子均具有稀有气体原子的结构.若X的原子序数为a.则Y 的核电荷数不可能是: A.a+8-m-n B.a+16-m-n C.a-m-n D. a-8+m+n 根据化学式XmYn推算X.Y两元素的化合价分别为+n.-m.此时所形成的阳离子Xn+和阴离子Ym-均具有稀有气体原子的结构.所对应的稀有气体原子有以下三种情况:同一种原子.则有a-n=b+m,相差一周期.则a-n+8=b+m,相差两周期.则a-n+16=b+m.故答案D错误. 例5:若短周期中的两元素可以形成原子个数比为2:3的化合物.则两种元素的 原子序数之差不可能是: A.1 B.3 C.5 D.6 根据题意.两元素可形成A2B3型化合物.A为+3价即为ⅢA族的Al或B及ⅤA族的N或P,可形成-2价的元素为ⅥA族的O或S.ⅢA.ⅤA族元素的原子序数为 奇数.ⅥA族元素的原子序数为偶数.因此其差值不可能为偶数.故答案应选D. 此题利用了短周期元素的主族序数与原子序数的关系:主族序数为奇数则原子序数为奇数,主族序数为偶数则原子序数为偶数.
网址:http://m.1010jiajiao.com/timu3_id_50614[举报]
废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4?7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:
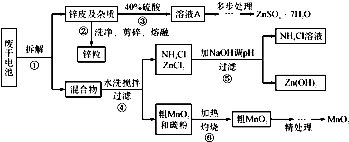
(1)操作②中所用的加热仪器应选
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
由上表数据分析应调节溶液pH最好为
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
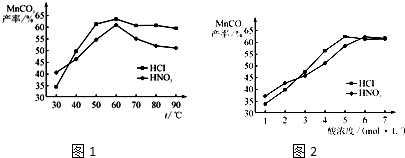
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
查看习题详情和答案>>

(1)操作②中所用的加热仪器应选
坩埚
坩埚
(填“蒸发皿”或“坩埚”).(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
.(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
| NH3?H2O的Kb | Zn 2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
a
a
(填字母).a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
.步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
.步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
2MnCO3+O2
2MnO2+2CO2
| ||
2MnCO3+O2
2MnO2+2CO2
.
| ||
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
60
60
℃左右.②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
6
6
mol?L-1左右.
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
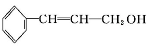
(甲)
分子式 | C9H8O |
部分性质 | 能使Br2/CCl4褪色 |
(乙)
分子式 | C16H14O2 |
部分性质 | 能使Br2/CCl4褪色 |
能在稀硫酸中水解 |
(丙)
(1)甲中所含官能团的名称为 、 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
甲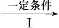
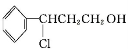
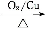 Y
Y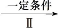 乙
乙
其中反应Ⅰ的反应类型为 ,反应Ⅰ的目的是 。
(3)已知:
RCH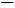 CHR'
CHR'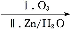 RCHO+R'CHO;2HCHO
RCHO+R'CHO;2HCHO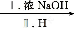 HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
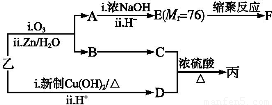
①下列物质不能与C反应的是 (选填序号)。
A.金属钠 B.HBrC.Na2CO3溶液D.乙酸
②写出由E生成F的反应方程式: ?????????????????????????????????????????????????????????? 。
③D有多种同分异构体,写出其中一种能同时满足下列条件的异构体结构简式 。
a.苯环上连接着三种不同官能团
b.能发生银镜反应
c.能与Br2/CCl4发生加成反应
d.遇FeCl3溶液显示特征颜色
④写出丙的结构简式: 。
查看习题详情和答案>>