网址:http://m.1010jiajiao.com/timu3_id_50207[举报]
A.①>④>②>③?
B.④>①>③>②?
C.①>④>③>②?
D.④>①>②>③?
查看习题详情和答案>>相同温度下,体积均为0.5L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) 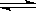 2XY3(g) △H= -92.6kJ/mol;反应在起始及达到平衡时的有关数据如下表所示:下列叙述不正确的是
2XY3(g) △H= -92.6kJ/mol;反应在起始及达到平衡时的有关数据如下表所示:下列叙述不正确的是
|
容器 编号 |
起始时各物质的物质的量/mol |
达平衡时体系能量的变化 |
||
|
X2 |
Y2 |
XY3 |
||
|
① |
1 |
3 |
0 |
放热46.3kJ |
|
② |
0.4 |
1.2 |
1.2 |
Q |
A.容器①达到平衡时X2和Y2的转化率相等
B.达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C.容器②达平衡吸热
D.若容器①体积为1L,起始投料不变,则达平衡时放出的热量大于46.3kJ
查看习题详情和答案>>
相同温度下,体积均为0.5L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) 2XY3(g) △H= -92.6kJ/mol;反应在起始及达到平衡时的有关数据如下表所示:下列叙述不正确的是
| 容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3kJ |
| ② | 0.4 | 1.2 | 1.2 | Q |
A.容器①达到平衡时X2和Y2的转化率相等
B.达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C.容器②达平衡吸热
D.若容器①体积为1L,起始投料不变,则达平衡时放出的热量大于46.3kJ
查看习题详情和答案>>
相同温度下,在四个密闭容器中发生可逆反应:H2(g)+I2(g)![]() 2HI(g),实验测得起始、平衡时的有关数据如下表所示:
2HI(g),实验测得起始、平衡时的有关数据如下表所示:
| 容器编号 | 起始时各物质的物质的量(mol) | 达平衡时体系的变化 | ||
| I2 | H2 | HI | ||
| ① | 1 | 3 | 0 | 放出热量:Q1=23.15kJ |
| ② | 0.8 | 2.8 | 0.4 | 平衡时碘化氢的体积分数为20% |
| ③ | 0 | 4 | 4 |
|
| ④ | 2 | 3 | 0 |
|
(1)下列叙述正确的是
A.四个容器中反应的平衡常数相等
B.反应的热化学方程式为:H2(g)+I2(g)![]() 2HI(g) △ H =23.15kJ/mol
2HI(g) △ H =23.15kJ/mol
C.平衡时,容器④中H2的转化率高于① D、容器②中达平衡时放出的热量Q2<23.15kJ
E、达到平衡后若将容器①的体积变为0.25 L,H2的转化率提高
(2)该温度下,在容积为1L密闭容器③中发生反应建立平衡,若达到平衡所需的时间为2min,则平均反应速率v(HI)= ,该温度下,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数 K= 。
2HI(g)的平衡常数 K= 。
(3)平衡常数K只受温度的影响,与浓度、压强等因素无关,故可利用平衡常数来判断平衡是否移动及移动的方向。例如,若③为一个装有可移动活塞的容器,上述平衡达成后用外力将活塞向内推至容积为0.5L并恢复原温度,则由于
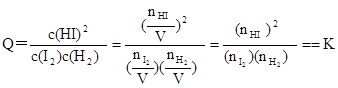 ,
,
可判断平衡将 (填“正向”、“逆向”或“不”)移动。
(4)如果保持温度和压强不变,向③的平衡体系中加入1.6molI2,平衡将 (填“正向”、“逆向”或“不”)移动,理由是 。
查看习题详情和答案>>
相同温度度,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)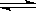 2XY3(g)△H=-92.6kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g)△H=-92.6kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
|
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
|
X2 |
Y2 |
XY3 |
||
|
① |
1 |
3 |
0 |
放热46.3 kJ |
|
② |
0.8 |
2.4 |
0.4 |
Q(Q>O) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20L.则达平衡时放出的热量大于46.3kJ
查看习题详情和答案>>