摘要:21世纪初我国能源工业发展的前景是 A.风能.太阳能.沼气.地热等新能源将为城乡居民普遍利用 B.能源消费构成中将以石油为主 C.按人口平均.水能发电量将居世界首位 D.部分沿海地区将适当发展核电工业
网址:http://m.1010jiajiao.com/timu3_id_48526[举报]
[化学一选修/化学与技术]纯碱一直以来都是工业生产的重要原料,很长一段时间纯碱的制法都被欧美国家所垄断.20世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法),并在天津建造了我国独立研发的第一家制碱厂.其制碱原理的流程如下:

(1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明) 、 .
(2)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是: 、 (填化学式).这两种气体在使用过程中是否需要考虑添加的顺序 (填“是”或“否”),原因是: .
(3)在沉淀池中发生的反应的化学方程式是 .
(4)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环.从母液中可以提取的副产品的应用是 (举一例).
查看习题详情和答案>>

(1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明)
(2)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是:
(3)在沉淀池中发生的反应的化学方程式是
(4)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了
(2010?梅州一模)有关自然资源开发利用的一些说法中,正确的是( )
①海水淡化与化工生产、能源技术相结合是海水综合利用的重要方向
②甲烷水合物被认为是21世纪新型洁净能源,目前已成为各国关注和研究的重要领域
③石油化工中的合成材料(常用塑料)在自然环境中容易降解
④我国在哥本哈根气候变化大会上作出大规模减排温室气体的承诺,温室气体是指SO2气体
⑤绿色合成提倡尽可能使用无毒、无害原料,可再生资源等.
①海水淡化与化工生产、能源技术相结合是海水综合利用的重要方向
②甲烷水合物被认为是21世纪新型洁净能源,目前已成为各国关注和研究的重要领域
③石油化工中的合成材料(常用塑料)在自然环境中容易降解
④我国在哥本哈根气候变化大会上作出大规模减排温室气体的承诺,温室气体是指SO2气体
⑤绿色合成提倡尽可能使用无毒、无害原料,可再生资源等.
查看习题详情和答案>>
二甲醚(CH3OCH3)被称为21世纪的新型能源,是一种高效、清洁能源.
Ⅰ.工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
下列说法正确的是
A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
(6)燃料电池正极消耗标准状况下空气的体积是
查看习题详情和答案>>
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
3CH4+CO2→2CH3OCH3
3CH4+CO2→2CH3OCH3
.(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
-246.1kJ/mol
-246.1kJ/mol
,830℃时反应③的K=1.0,则在催化反应室中反应③的K>
>
1.0(填“>”、“<”或“=”).(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
A、B、C
A、B、C
.(填字母序号)A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
甲醇和水、CO和H2
甲醇和水、CO和H2
.Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
CH3OCH3-12e-+16OH-=2CO32-+11H2O
CH3OCH3-12e-+16OH-=2CO32-+11H2O
.(6)燃料电池正极消耗标准状况下空气的体积是
2.8L
2.8L
(空气中O2体积分数以20%计算).二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:
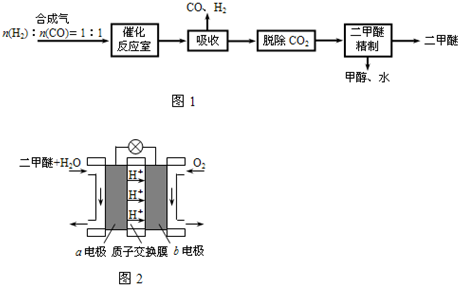
催化反应室中(压力2.0~10.0Mpa,温度300℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)催化反应室中的总反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g).
该反应的△H=
(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将
(3)上述流程中二甲醚精制的实验操作名称为
(4)图2为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为
查看习题详情和答案>>

催化反应室中(压力2.0~10.0Mpa,温度300℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)催化反应室中的总反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g).
该反应的△H=
-246.1kJ/mol
-246.1kJ/mol
.催化反应室中采用300℃的反应温度,理由是提高化学反应速率
提高化学反应速率
.(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将
逆向进行
逆向进行
(填“正向进行”、“逆向进行”或“处于平衡状态”).(3)上述流程中二甲醚精制的实验操作名称为
蒸馏
蒸馏
.(4)图2为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为
CH3OCH3+3H2O-12e-=2CO2+12H+
CH3OCH3+3H2O-12e-=2CO2+12H+
.(2011?如皋市模拟)二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能.
Ⅰ.工业制备二甲醚的生产流程如下:
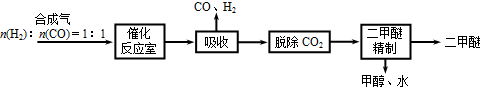
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)甲烷氧化可制合成气:CH4(g)+
O2(g)?CO(g)+2H2(g)△H=-35.6kJ/mol,该反应是
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
(3)上述流程中,可循环使用的物质有
Ⅱ.如图为绿色电源“直接二甲醚燃料电池”的工作原理示意图.
(1)b电极是
(2)a电极的反应式为
查看习题详情和答案>>
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)甲烷氧化可制合成气:CH4(g)+
| 1 | 2 |
自发
自发
反应(填“自发”或“非自发”).
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
-246.1kJ/mol
-246.1kJ/mol
.830℃时反应③的K=1.0,则在催化反应室中反应③的K>
>
1.0(填“>”、“<”或“=”)(3)上述流程中,可循环使用的物质有
CO、H2、甲醇和水
CO、H2、甲醇和水
.Ⅱ.如图为绿色电源“直接二甲醚燃料电池”的工作原理示意图.
(1)b电极是
正
正
极.(2)a电极的反应式为
(CH3)2O-12e-+3H2O═2CO2+12H+
(CH3)2O-12e-+3H2O═2CO2+12H+
.