网址:http://m.1010jiajiao.com/timu3_id_48423[举报]
 pD(g)+qE(s),△H>0(m、n、p、q为最简整数比)。
pD(g)+qE(s),△H>0(m、n、p、q为最简整数比)。 
(2)T℃时该反应的化学平衡常数K的数值为____。
(3)反应达到平衡后,第6 min时:
①若升高温度,D的物质的量变化曲线最可能的是____(用图乙中的a~c的编号作答);
②若在6 min时仍为原平衡,此时将容器的容积压缩为原来的一半。请在图丙中画出6 min后B 浓度的变化曲线。
A.0.4 mol A+0.7 mol B+0.9 mol D+0.3 mol E
B.0.6 mol A+0.8 mol B+0.6 mol D+0.5 mol E
C.1.5 mol D+0.5 mol E
D.0.5 mol A+0.5 mol B+1.2 mol D+0.4 mol E
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是_________
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
在一个容积为![]()
![]() ,K为只与温度有关的常数。回答下列问题:
,K为只与温度有关的常数。回答下列问题:
(1)用B的浓度变化来表示的反应速率v(B)=___________,A的转化率为___________,该反应在此温度下的K=___________。
(2)在相同实验条件下,若在同一容器中加入2.0 mol A和8.0 mol B,若要求平衡后C在反应混合气中体积分数不变,则还应加入C___________mol。
(3)在相同实验条件下,若在同一容器中加入3.0 mol A和一定量的B,平衡时C的物质的量为3.0 mol,则加入的B的物质的量为___________mol。
查看习题详情和答案>>在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是 ( )
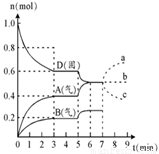
A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667mol/(L·min)
B.该反应的化学方程式为2D(s) 2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
C.已知反应的△H>0,则第5分钟时图像呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看习题详情和答案>>
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如下图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为 。
(2)根据右图写出该反应的化学方程式 。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应是 (填“放热”或“吸热”)反应。若在第7分钟时增加D的物质的量,A的物质的量变化正确的是_____(用图中a~c的编号回答)
(4)某同学在学习了“化学反应速率和化学平衡”专题后,发表如下观点,你认为错误的是 。
a.化学反应速率理论是研究怎样在一定时间内快出产品
b.化学反应速率理论是研究怎样提高原料转化率
c.化学平衡理论是研究怎样使用有限原料多出产品
d.正确利用化学反应速率和化学平衡理论都可以提高化工生产的综合效益
查看习题详情和答案>>
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |

该工艺的主要流程如下:
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为 。
(2)反应①的目的是 。
(3)若用NaOH溶液调节pH,则转化②的离子方程式为 。
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是 。
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g) 2SO3(g)
ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g)
ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。
①该条件下反应2SO2(g)+O2(g) 2SO3(g)
的平衡常数为_____;
2SO3(g)
的平衡常数为_____;
②下列措施能使 增大的是_____。
增大的是_____。
A.升高温度
B.保持温度和容积不变,再充入2 mol He
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂
查看习题详情和答案>>