网址:http://m.1010jiajiao.com/timu3_id_46875[举报]
氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。

按要求回答下列问题:
(1)操作①的名称是______________,检验溶液2中是否含有杂质离子的试剂是?????????????????? 。操作②需在氯化氢气流中经过加热浓缩、??????? 、过滤、洗涤、干燥。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是??????????????????????? ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
a.NaOH???????? b.NH3·H2O??????? c.CuO?????? d.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式: ????????????????????? 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→?? 、 → 、 → 、 → 。实验开始前要进行一步重要操作,其操作名称是?????????????????????????? 。
②反应时,盛粗铜粉的试管中的现象是?????????????????? ??????????? 。
③反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中的正极反应式为??????????????? 。
查看习题详情和答案>>
氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
I.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物。现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯已省略)。按要求回答下列问题:

(1)按气流方向连接各仪器接口顺序是:a ??? 、???
??? 、???  ???? 、????
???? 、????  ??? 、 ??
??? 、 ??  ?????
?????
(2)写出加热时硬质试管中发生化学反应的方程式是????????? 。
(3)反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中正极反应式是????????????? .
II.将上述实验制得的固体产物按如下流程操作,试回答下列问题:

(1)检验溶液2中是否含有杂质离子的试剂是??????????? ;
(2)某同学用实验制得的CuCl2·2H2O晶体配制0.1 mol·L-1的CuCl2溶液,在称量出CuCl2·2H2O晶体后,溶解该晶体的具体操作为 ??????????????? ?
(3)溶液l可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)????
a.NaOH??? b.NH3·H2O??? C.CuO? d.CuSO4??? e.Cu2(OH)2CO3
(4)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:????????????????????????? .
查看习题详情和答案>>
(10分)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知pH为5时,+2价铜已开始以碱式盐的形式沉淀。某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:
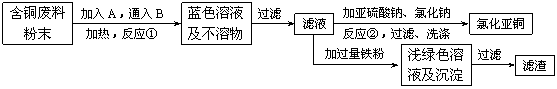

⑴ 加入的A是 ,通入的B是 。
 ⑵ 反应②的离子方程式是 。
⑵ 反应②的离子方程式是 。
为提高Cu2Cl2的产率,常在反应②的溶液中加入
适量稀碱溶液,控制pH为3.5。这样做的目
的是 。
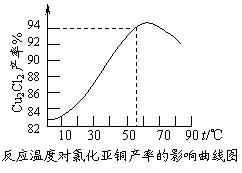
⑶ 保持各反应物的最佳配比,改变温度,测得
Cu2Cl2产率的变化如下图所示。则溶液温度控
制在 时,Cu2Cl2的产率已达到94%,
当温度高于65℃时,Cu2Cl2产率会下降,其原
因可能是 。
查看习题详情和答案>> 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.(1)超细铜粉的某制备方法如下:
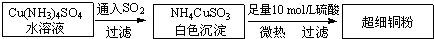
①[Cu(NH3)4]SO4中所含的化学键有
②NH4CuSO3中的金属阳离子的核外电子排布式为:
③NH3分子中N原子的杂化方式为:
④SO42-离子的空间构型为
(2)氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
①出上述制备CuCl的离子方程式:
| ||
| ||
②CuCl的晶胞结构如上图所示,其中Cl原子的配位数为
③CuCl的熔点比CuO的熔点
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4?5H2O与H2O的质量之比.
(2)准确称取所制备的0.250 0g CuCl样品置于一定量的0.5 mol?L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol?L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液.有关反应的离子方程式为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+通过计算说明上述样品中CuCl的质量分数是否符合标准.