摘要:27.MnO2+2Ci+4H+ Mn2++Cl2↑+2H2O (3)安全瓶.防止倒吸 高温 (4)3Fe+4H2O Fe3O4+4H2 (5)2OH-+Cl2=Cl-+ClO-+H2O
网址:http://m.1010jiajiao.com/timu3_id_46131[举报]
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.

(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:
(2)实验室用装置E制备Cl2,其反应的离子方程式为:
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用离子方程式表示)
查看习题详情和答案>>

(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:
分液漏斗的玻璃塞没有取下来
分液漏斗的玻璃塞没有取下来
;(2)实验室用装置E制备Cl2,其反应的离子方程式为:
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
| ||
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
.若有6mol的HCl参加反应,则转移的电子总数为
| ||
3×6.02×1023
3×6.02×1023
;(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:
品红褪色
品红褪色
,D:品红褪色
品红褪色
.②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:
褪色的品红又恢复成红色
褪色的品红又恢复成红色
,D:无明显现象
无明显现象
.(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用离子方程式表示)
Cl2+SO2+2H2O═4H++2Cl-+SO42-
Cl2+SO2+2H2O═4H++2Cl-+SO42-
.(2011?常州三模)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2=MnSO4 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是
查看习题详情和答案>>

已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH
小
小
(填“大”或“小”),该流程可与工业制备硫酸
工业制备硫酸
(填工业生产名称)联合,生产效益更高.(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
,这样设计的目的和原理是使Fe2+转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)
使Fe2+转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀
与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀
.(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是
使MnCO3沉淀完全
使MnCO3沉淀完全
,溶液的pH不能过低的原因是MnCO3沉淀量少,NH4HCO3与酸反应
MnCO3沉淀量少,NH4HCO3与酸反应
.(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是
节约能源、治理含SO2的工业废气等
节约能源、治理含SO2的工业废气等
.(答对1个即可)在一定条件下可实现如图所示物质之间的转化.

已知D为黄绿色气体,请填空:
(1)写出下列反应的化学方程式:
①C固体加热
(2)写出下列反应的离子方程式;
①A→D+E
(3)检验D气体的方法是
查看习题详情和答案>>

已知D为黄绿色气体,请填空:
(1)写出下列反应的化学方程式:
①C固体加热
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
;②A→B
| ||
2MnO2+4KOH+O2
2K2MnO4+2H2O
| ||
2MnO2+4KOH+O2
2K2MnO4+2H2O
.
| ||
(2)写出下列反应的离子方程式;
①A→D+E
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
| ||
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
;②B→C+A
| ||
3MnO4-+4H+=2MnO4-+MnO2↓+2H2O
3MnO4-+4H+=2MnO4-+MnO2↓+2H2O
.(3)检验D气体的方法是
将D气体通入淀粉碘化钾溶液中,溶液变蓝色证明D气体为氯气
将D气体通入淀粉碘化钾溶液中,溶液变蓝色证明D气体为氯气
. A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:
A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:请回答下列问题:
(1)A溶液与B溶液反应的离子方程式
H++OH-=H2O
H++OH-=H2O
.(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为
MnO2+2Cl-+4H+
Mn2++Cl2+2H2O
| ||
MnO2+2Cl-+4H+
Mn2++Cl2+2H2O
| ||
(3)请写出B溶液分别与Cl2、Al(OH)3反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
,Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
(4)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是:
Al(OH)3、NaHCO3
Al(OH)3、NaHCO3
.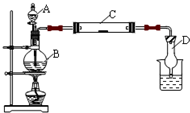 (2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
(2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:(1)怎样检验装置的气密性
关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱
关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱
;(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为
试纸变蓝色
试纸变蓝色
;写出B中发生反应的离子方程式
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
| ||
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
.
| ||
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是
将KI氧化成KIO3
将KI氧化成KIO3
.(4)D的作用是
防倒吸
防倒吸
.烧杯中加入的是氢氧化钠溶液
氢氧化钠溶液
.(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用
KMnO4、KClO3
KMnO4、KClO3
药品替代.若实验室暂时无浓盐酸,仍用此装置制取氯气,选用NaCl和浓硫酸
NaCl和浓硫酸
药品替代.