摘要:热化学方程式(近10年来的化学高考命题中的呈现率:70%) [点题]实验室用4mol SO2与2mol O2进行下列反应: 2SO2(g)+O2(g) 2SO3(g), ΔH=―196.64KJ/mol.当放出314.624KJ热量时.SO2的转化率为 A.40% B.50% C.80% D.90% [点晴] A [点题]甲醇是一种重要的醇.它可以做内燃机的燃料和溶剂.也是一种重要的化工原料.同时它在废水处理中也有重要应用. (1)在25℃时1g甲醇完全燃烧后恢复至原温度时可放出24.2kJ热量.则25℃时1mol甲醇完全燃烧生成100℃时CO2和水蒸气应放出 J热量.(有关热量公式Q=m·C·△t Q=m·J. 已知水的比热C=4.18J·g-1·℃-1.水的液化热J=2253J·g-1 m:物质质量 △t:温度差 假设100℃时水完全汽化.并忽略CO2吸热) (2)甲醇加入含氨的废水中.在一种微生物作用下发生反应: 2O2+NH3=NO3-+H++H2O. 6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O 若某废水用上述方法处理时.NH3→NO3-的转化率为95%.NO3-→N2的转化率为86%.若每天处理此种含NH3为34mg/L的废水500m3(密度1g/cm3)需要甲醇多少千克?(要求写出解题步骤.保留至小数点后一位) [点晴](1)682, (2)解:由反应2O2+NH3=NO3-+H++H2O. 6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O 得关系式:6NH3-6NH3--5CH3OH-3N2↑ 根据关系式6NH3 5CH3OH 6mol 5×32×10-3kg 1000mol×95%×86% m(CH3OH) 答:消耗甲醇21.8kg
网址:http://m.1010jiajiao.com/timu3_id_46017[举报]
近来,制备和利用氢气这一清洁能源已有多项成果.(1)德国克莱斯公司成功研制了利用甲醇CH3OH)车载制氢燃料电池工艺,其原理如图1所示,请观察此图回答: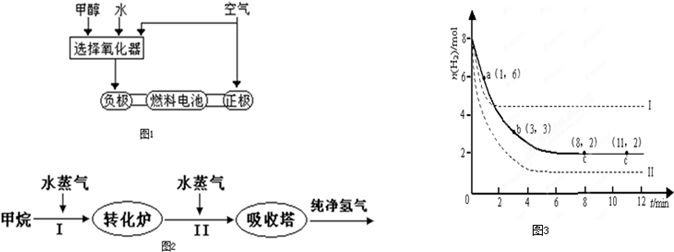
①此碱性燃料电池的正极反应式为
②甲醇与水反应制取氢气的化学方程式
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图2:
①此流程的第II步反应为:CO(g)+H2O(g)
H2(g)+CO2(g),平衡常数随温度的变化如下表.
在830℃,n(CO)、n(H2O)、n(H2)、n(CO2)的物质的量分别是1、5、2、3投入恒容反应器发生上述反应,反应开始时,向
②若400℃时,第Ⅱ步反应生成l mol氢气放出的热量为33.2kJ,第I步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1 则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
(3)工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线).
①a点正反应速率
②求平衡时氢气的转化率
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图3虚线所示,曲线I对应的实验条件改变是
查看习题详情和答案>>

①此碱性燃料电池的正极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;②甲醇与水反应制取氢气的化学方程式
CH3OH+H2O?3H2+CO2
CH3OH+H2O?3H2+CO2
.(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图2:
①此流程的第II步反应为:CO(g)+H2O(g)
| 高温 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
逆
逆
(填正、逆)反应方向进行.②若400℃时,第Ⅱ步反应生成l mol氢气放出的热量为33.2kJ,第I步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1 则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1
.(3)工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)
将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线).
①a点正反应速率
大于
大于
(填大于、等于或小于)逆反应速率.②求平衡时氢气的转化率
75%
75%
和该条件下反应的平衡常数K=0.5
0.5
.③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图3虚线所示,曲线I对应的实验条件改变是
升高温度
升高温度
,曲线II对应的实验条件改变是增大压强
增大压强
.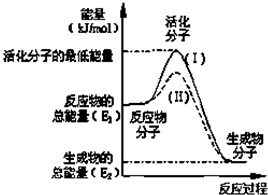 在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应.使普通分子变成活化分子所需提供的平均能量叫活化能,其单位通常用kJ?mol-1表示.请观察如图,回答下列问题:
在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应.使普通分子变成活化分子所需提供的平均能量叫活化能,其单位通常用kJ?mol-1表示.请观察如图,回答下列问题:(1)图中所示反应是
(2)已知热化学方程式:
H2(g)+
| 1 | 2 |
该反应的活化能为167.2kJ?mol-1,则其逆反应的活化能为
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.(1)图中反应是
放热
放热
(填“吸热”或“放热”)反应.(2)对于同一反应,图中虚线( II)与实线( I)相比,改变的条件是
催化剂
催化剂
,对反应热是否有影响?无/没影响
无/没影响
,原因是反应热只与反应物和生成物的始态有关/催化剂只改变活化能
反应热只与反应物和生成物的始态有关/催化剂只改变活化能
.(3)已知 C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
CO(g)+
| 1 |
| 2 |
请写出C(s)与O2(g)反应生成CO(g)的热化学方程式
C(s)+
O2(g)=CO(g)的△H=-110.5kJ/mol
| 1 |
| 2 |
C(s)+
O2(g)=CO(g)的△H=-110.5kJ/mol
.| 1 |
| 2 |
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.
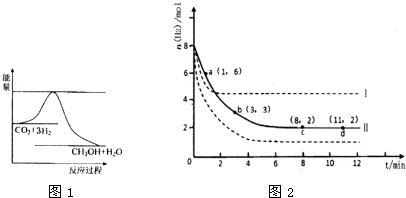
(1)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
①该反应是
②反应体系中加入催化剂对反应热是否有影响?
(2)若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线).
①该条件下反应的平衡常数K=
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图2中虚线所示,曲线I对应的实验条件改变是
③下列措施中能使H2转化率增大的是
A.升高温度 B.充入He(g),使体系压强增大 C.将H2O(g)从体系中分离出来 D.再充入3mol CO2
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.
已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H2=-285.8kJ?mol-1
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
查看习题详情和答案>>

(1)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
①该反应是
放热
放热
(填“吸热”或“放热”)反应.②反应体系中加入催化剂对反应热是否有影响?
否
否
(填“是”或“否”).(2)若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线).
①该条件下反应的平衡常数K=
0.5
0.5
.②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图2中虚线所示,曲线I对应的实验条件改变是
升高温度
升高温度
,曲线Ⅱ对应的实验条件改变是增大压强
增大压强
.③下列措施中能使H2转化率增大的是
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大 C.将H2O(g)从体系中分离出来 D.再充入3mol CO2
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.
已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ?mol-1
H2(g)+
| 1 | 2 |
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ?mol-1
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ?mol-1
.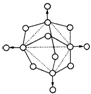 磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)
磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)