网址:http://m.1010jiajiao.com/timu3_id_44970[举报]
某化学课外活动小组在实验室做了如下一系列实验: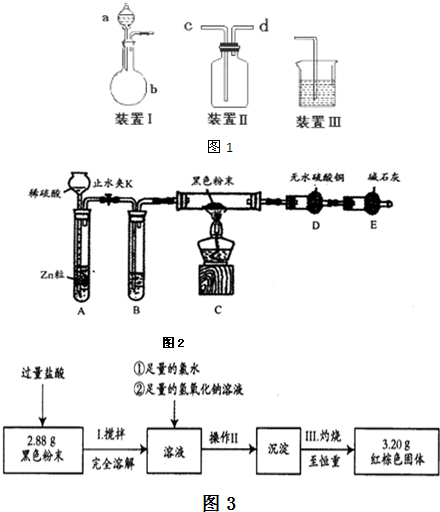
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
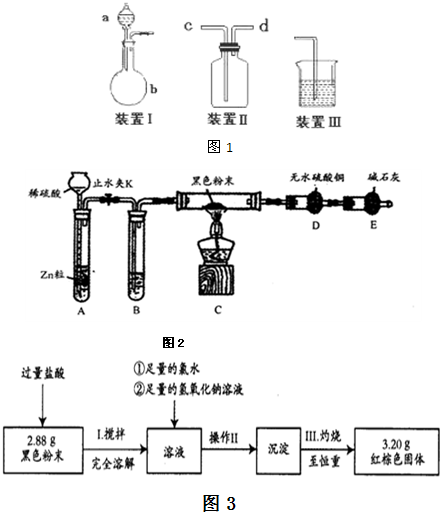
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
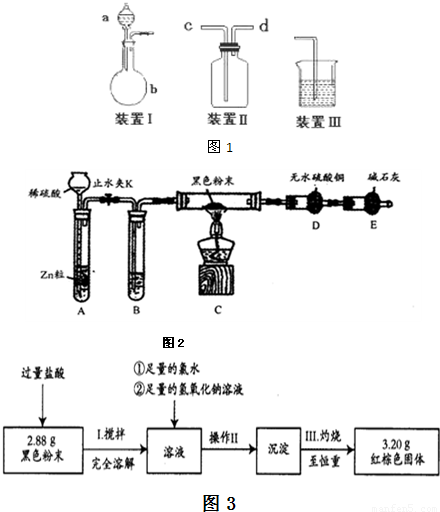
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
查看习题详情和答案>>
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
查看习题详情和答案>>

(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3)和
(2)图1中烧瓶中发生的离子反应方程式为
(3)图2是图1的改进装置,其优点有:①
为符合绿色化学的要求,某研究性学习小组进行了如下设计:
方案1:以空气为氧化剂.将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O晶体.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加Fe2(SO4)3,即发生反应.反应完全后向其中先后加入物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用.[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7和6.4.]
(4)方案l中的A仅器名称是
(5)方案2中物质甲可以是
a.Cu b.CuCO3 c.CuO d.氨水 e.氯水 f.双氧水
取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液
指出你认为不合理的方法及存在的问题
(6)用铜粉制硫酸铜,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜粉反应,其化学方程式是
| ||
| ||
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。请回答相关问题:
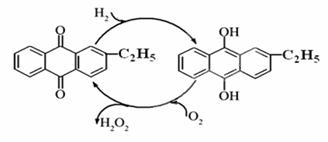
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如下图,此过程的总方程式为 。
(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式 .
ii.测定H2O2水溶液pH的方法为(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
i.实验①和②的目的是_______。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_________。
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。
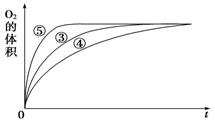
分析该图能够得出的实验结论是____________。
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:
MnO4-+H2O2+H+ —Mn2++H2O+ O2↑
i.请配平以上离子方程式
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000 mol·L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为 mol·L-1。
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果 (“偏高”或“偏低”或“不变”)。
查看习题详情和答案>>