摘要:14.含11.2gKOH的稀溶液与1L0.12mol/L的H2SO4 溶液反应放出11.46kJ的热量.该反应的热化学方程式是 A.KOH(aq)+1/2H2SO4 (aq)=1/2K2SO4(aq)+H2O (1) △H= 一11.46kJ/mol B.2KOH(aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (g) △H= 一114.6kJ/mol C.2KOH(aq)+H2SO4 (aq) =K2SO4(aq)+2H2O (1) △H= 一114.6kJ/mol D.KOH(aq)+1/2H2SO4 (aq)=1/2K2SO4(aq)+H2O (1) △日= 一57.3kJ/mol
网址:http://m.1010jiajiao.com/timu3_id_43856[举报]
(1)已知含11.2g KOH的稀溶液与1L0.1mol?L-1的H2SO4稀溶液反应放出11.46KJ的热量.请写出KOH的稀溶液与的H2SO4稀溶液发生中和反应,表示中和热的热化学方程式为
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2 (g)+O2(g)=2H2O(g)△H1,
②2H2 (g)+O2(g)=2H2O(l)△H2,则△H1和△H2的关系为
查看习题详情和答案>>
KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O△H=-56.3kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O△H=-56.3kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2 (g)+O2(g)=2H2O(g)△H1,
②2H2 (g)+O2(g)=2H2O(l)△H2,则△H1和△H2的关系为
△H1>△H2
△H1>△H2
.反应2C + O2=2CO 的能量变化如右图所示。含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是

A.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ 1
B.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ
C.该反应的热化学方程式是:2C(s) + O2(g)=2CO(g) ΔH=-110.5 kJ/mol
D.表示中和热的热化学方程式2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
查看习题详情和答案>>
含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.4kJ的热量,下列能正确表示中和热的热化学方程式是
A. KOH(aq) + 1/2 H2SO4(aq) =1/2K2SO4(aq) + H2O (l);ΔH=-11.46kJ/mol
B.2KOH(s) + H2SO4(aq) = K2SO4(aq) + 2H2O (l);ΔH=-114.6kJ/mol
C.2KOH(aq) + H2SO4 =K2SO4(aq) + H2O (l) ;ΔH=+114.6kJ/mol
D.KOH (aq) + 1/2 H2SO4(aq) = 1/2 K2SO4(aq) + H2O (l) ;ΔH=-57.3kJ/mol
查看习题详情和答案>>
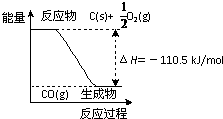 反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )
反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )