网址:http://m.1010jiajiao.com/timu3_id_424559[举报]
Fe3+、 Al3+、Ca2+、Mg2+)
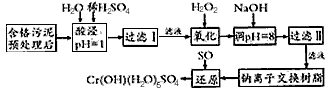

(1)酸浸时,为了提高浸取率可采取的措施为:____________ (至少一条)。
(2)调pH =8是为了除去________(选填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是________。
(4)试配平还原反应方程式:
①
 Na2Cr2O7+
Na2Cr2O7+ SO2+
SO2+  H2O=
H2O= Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+ Na2SO4;
Na2SO4;②生成1 molCr(OH)(H2O)5SO4消牦SO2的物质的量为_______。
(5)常温下,向含有Cr(OH)3沉淀的浊液中加入NaOH固体,Cr(OH)3的溶解度将____(填“增大”“减小”或 “不变”,下同),Ksp[Cr(OH)3]将______。
(15分)现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。![]() 已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
![]() ②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
![]() ③C的氢化物分子G是具有10电子微粒,且以发生下列转化
③C的氢化物分子G是具有10电子微粒,且以发生下列转化
![]()
![]() G
G  P
P  Q
Q 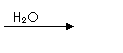 M+P
M+P
![]() ④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
![]() ⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)B元素的名称是 ;
(1)B元素的名称是 ;
![]() (2)E元素的原子结构示意图是 。
(2)E元素的原子结构示意图是 。
![]() (3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
![]()
|
![]() (4)G的电子式为 。化合物X所含化学键类型有 。
(4)G的电子式为 。化合物X所含化学键类型有 。
![]() (5)A的氧化物与NaOH溶液反应的离子方程式:
(5)A的氧化物与NaOH溶液反应的离子方程式:
![]() T与F单质的水溶液反应的离子方程式为 ;
T与F单质的水溶液反应的离子方程式为 ;
![]() G与D的单质反应的化学方程式为 ;
G与D的单质反应的化学方程式为 ;
![]() M与铜反应的化学方程式为 。
M与铜反应的化学方程式为 。
(15分)现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
③C的氢化物分子G是具有10电子微粒,且以发生下列转化

④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
![]() ⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)B元素的名称是 ;
(1)B元素的名称是 ;
(2)E元素的原子结构示意图是 。
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
|
(4)G的电子式为 。化合物X所含化学键类型有 。
(5)A的氧化物与NaOH溶液反应的离子方程式:
T与F单质的水溶液反应的离子方程式为 ;
G与D的单质反应的化学方程式为 ;
M与铜反应的化学方程式为 。
查看习题详情和答案>>现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
③C的氢化物分子G是具有10电子微粒,且以发生下列转化



G P Q M+P
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ;
(2)E元素的原子结构示意图是 。
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
(4)G的电子式为 ,属于 分子(填“极性”或“非极性”),用离子方程式表示G使红色石蕊试液变蓝的因: 。
化合物X所含化学键类型有 。
(5)A的氧化物与NaOH溶液反应的离子方程式: 。
T与F单质的水溶液反应的离子方程式为 ;
G的水溶液与足量的T反应的化学方程式为 ;
查看习题详情和答案>>

(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有__________________(要求写出两条)。
(2)滤渣I的主要成分有________________
(3)从滤液Ⅱ中可回收利用的主要物质有______________________
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3=Mg(ClO3)2
+2NaCl已知四种化合物的溶解度(s)随温度(T)变化曲线如下图所示:

②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:__________________________。除去产品中该杂质的方法是:___________________________。