摘要:28.A.B.C.D.E.F是中学化学中常见的气体.它们均由短周期元素组成.具有如下性质: ①B能使湿润的红色石蕊试纸变蓝. D.F不能使湿润的石蕊试纸变色, ②A能使湿润的蓝色石蕊试纸先变红.后褪色,将红热的铜丝放入装有A的瓶中.瓶内充满棕黄色的烟, ③将点燃的镁条放入装有E的瓶中.镁条剧烈燃烧.生成白色粉末.瓶内壁附着黑色颗粒, ④将A和D 在瓶中混合后于亮处放置几分钟.瓶内壁出现油状液滴并产生C, ⑤将A和B混合.得到F和C. 回答下列问题: (1)B分子的空间构型为 . E的电子式是 , (2)③中发生反应的化学方程式是 , (3)⑤中发生反应的化学方程式是 , (4)已知标准状况下体积为1.12L的D完全燃烧生成E和液态水时.放出热量44.5kJ,写出表示D燃烧热的热化学方程式 . (5)一定条件下.向废水中加入CH3OH.将HNO3还原成F.若该反应消耗16 gCH3OH转移3 mol电子,该反应的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_424364[举报]
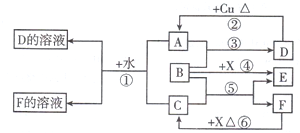
已知A-F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,A是一种大气污染物,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子.反应中部分生成物已略去.试回答下列问题:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是(用化学式表示)
(2)写出C原子的电子排布式
(3)写出反应③的化学方程式
(4)若将X加入B和稀硫酸的混合液后发现X溶解,溶液呈无色并产生气泡,写出反应的离子方程式:

查看习题详情和答案>>
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是(用化学式表示)
MnO2>Cl2>H2O2>H2SO4
MnO2>Cl2>H2O2>H2SO4
;(2)写出C原子的电子排布式
1S22S22P63S23P5
1S22S22P63S23P5
,B在生活中的一种用途是消毒
消毒
;(3)写出反应③的化学方程式
SO2+H2O2=H2SO4
SO2+H2O2=H2SO4
;(4)若将X加入B和稀硫酸的混合液后发现X溶解,溶液呈无色并产生气泡,写出反应的离子方程式:
2H++H2O2+MnO2═Mn2++O2↑+2H2O
2H++H2O2+MnO2═Mn2++O2↑+2H2O
.
A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性.F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末.这些物质之间满足如下图所示的转化关系,图中部分生成物已略去.
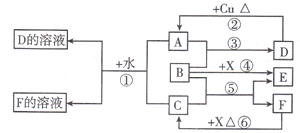
(1)写出下列物质的化学式:A
(2)B的电子式是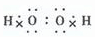
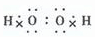 .根据图中信息,B、C、X的氧化性由强到弱的顺序是
.根据图中信息,B、C、X的氧化性由强到弱的顺序是
(3)反应⑥的离子方程式是
(4)在反应⑥中,F表现的性质是
查看习题详情和答案>>

(1)写出下列物质的化学式:A
SO2
SO2
,FHCl
HCl
.(2)B的电子式是
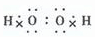
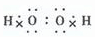
MnO2>Cl2>H2O2
MnO2>Cl2>H2O2
(用化学式表示).(3)反应⑥的离子方程式是
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(4)在反应⑥中,F表现的性质是
还原性、酸性
还原性、酸性
,当生成0.75mol C时,被氧化的还原剂的物质的量是1.5 mol
1.5 mol
.A-N是中学化学中常见的单质及化合物,A、B、F三种分子中的电子总数相同,A、C、D均为可燃性气体,B为无色液体;D、E、G、J、M为单质,其中J为黑色粉末,M为中学常见的金属,N可用作耐高温材料.各物质间存在下列转化关系(部分产物略去):
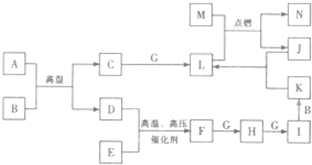
请回答下列问题:
(1)B的电子式为
(2)写出M与L反应的化学方程式
(3)写出加热条件下J与K的浓溶液反应的化学方程式
(4)简述实验室保存K的浓溶液的方法 .
查看习题详情和答案>>

请回答下列问题:
(1)B的电子式为
(2)写出M与L反应的化学方程式
(3)写出加热条件下J与K的浓溶液反应的化学方程式
(4)简述实验室保存K的浓溶液的方法