摘要:4.氯化铁能腐蚀铜(2FeCl3+Cu=2FeCl2+CuCl2).工业上常用此原理生产印刷线路板.从废液中回收铜并得到FeCl3溶液循环利用的主要流程如下: (1)写出步骤Ⅱ中发生反应的离子方程式 . . (3)向滤液B中加入适量的H2O2可得到FeCl3溶液并循环使用. 试写出该反应的化学方程式 . (4)某校化学小组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究.请回答: Ⅰ.写出A试管中发生反应的化学方程式 ,若有1摩铜完全反应.则被还原的H2SO4的物质的量为 . Ⅱ.B试管管口堵的棉花可以事先用下列 试剂浸泡. ①KMnO4酸性溶液 ②浓硫酸 ③NaOH溶液
网址:http://m.1010jiajiao.com/timu3_id_422965[举报]
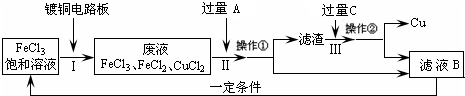
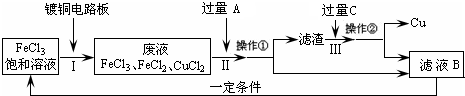
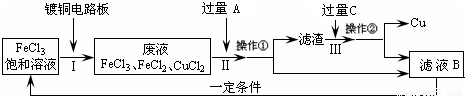
氯化铁能腐蚀铜(2FeCl3+Cu=2FeCl2+CuCl2),工业上常用此原理生产印刷线路板(步骤Ⅰ).从废液中回收铜并得到FeCl3溶液循环利用的主要流程如下:
(1)写出步骤Ⅱ中发生反应的离子方程式
(2)试剂C是(填名称)
(3)若在实验室中完成上述流程,操作①中属于
(4)在步骤Ⅲ中加入过量C溶液的目的是
查看习题详情和答案>>

(1)写出步骤Ⅱ中发生反应的离子方程式
Fe+2Fe3+=3Fe2+;Fe+Cu2+=Fe2++Cu
Fe+2Fe3+=3Fe2+;Fe+Cu2+=Fe2++Cu
.(2)试剂C是(填名称)
盐酸
盐酸
.(3)若在实验室中完成上述流程,操作①中属于
过滤
过滤
操作(填名称).(4)在步骤Ⅲ中加入过量C溶液的目的是
溶解滤渣中的铁生成氯化亚铁溶液,循环使用
溶解滤渣中的铁生成氯化亚铁溶液,循环使用
.
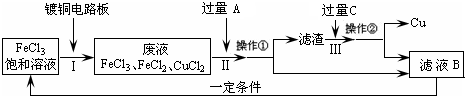
氯化铁能腐蚀铜(2FeCl3+Cu═2FeCl2+CuCl2),工业上常用此原理生产印刷线路板(步骤Ⅰ).从废液中回收铜并使FeCl3溶液循环利用的主要流程如图所示:

(1)写出步骤Ⅱ中发生反应的一个离子方程式 .
(2)向滤液B中加入适量的H2O2可得到FeCl3溶液并循环使用.试写出该反应的化学方程式 .
(3)某校化学小组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:
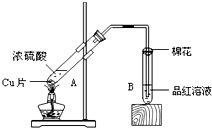
Ⅰ.若A中有1mol Cu完全反应,则被还原的H2SO4的物质的量为 .
Ⅱ.B试管管口堵的棉花可以事先用下列 试剂浸泡(填序号).
①酸性高锰酸钾溶液 ②浓硫酸 ③NaOH溶液. 查看习题详情和答案>>

(1)写出步骤Ⅱ中发生反应的一个离子方程式
(2)向滤液B中加入适量的H2O2可得到FeCl3溶液并循环使用.试写出该反应的化学方程式
(3)某校化学小组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:

Ⅰ.若A中有1mol Cu完全反应,则被还原的H2SO4的物质的量为
Ⅱ.B试管管口堵的棉花可以事先用下列
①酸性高锰酸钾溶液 ②浓硫酸 ③NaOH溶液. 查看习题详情和答案>>