摘要: 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
网址:http://m.1010jiajiao.com/timu3_id_422876[举报]
(1)0.05mol 的硫酸钠中含有
(2)质量都是50g的 HCl、NH3、CO2、O2四种气体中,在相同温度和相同压强条件下,体积最大的是
(3)配制100mL 0.2mol/L CuSO4溶液,需要CuSO4?5H2O质量为
(4)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为
(5)产生的Fe(OH)2白色沉淀迅速变为灰绿色,最后变为红褐色的化学方程式:
查看习题详情和答案>>
1.204×1023
1.204×1023
个氧原子;与5.85
5.85
g NaCl中所含有的Na+数目相同.(2)质量都是50g的 HCl、NH3、CO2、O2四种气体中,在相同温度和相同压强条件下,体积最大的是
NH3
NH3
.(填分子式)(3)配制100mL 0.2mol/L CuSO4溶液,需要CuSO4?5H2O质量为
5g
5g
.(4)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为
1.5mol/L
1.5mol/L
.(5)产生的Fe(OH)2白色沉淀迅速变为灰绿色,最后变为红褐色的化学方程式:
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
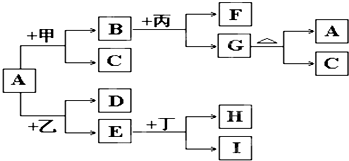
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为
(3)写出G→A+C的化学方程式:
(4)若A中混有杂质Al2O3,除去杂质的方法是加入过量的
(5)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中Fe2O3、Fe、H2SO4的物质的量之比为
查看习题详情和答案>>

(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是
H2SO4
H2SO4
,列举A物质的一种用途用作红色油漆和涂料
用作红色油漆和涂料
.(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为
CO
CO
,丁属于单质、酸、碱中的酸
酸
;在I溶液中加入氢氧化钠溶液,可以观察到的现象是生成白色沉淀,迅速变为灰绿色,最终变为红褐色
生成白色沉淀,迅速变为灰绿色,最终变为红褐色
,对应的离子方程式和化学方程式依次是Fe2++2OH-=Fe(OH)2↓
Fe2++2OH-=Fe(OH)2↓
,4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
;(3)写出G→A+C的化学方程式:
2Fe(OH)3
Fe2O3+3H2O
| ||
2Fe(OH)3
Fe2O3+3H2O
.
| ||
(4)若A中混有杂质Al2O3,除去杂质的方法是加入过量的
NaOH溶液
NaOH溶液
,该反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(5)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中Fe2O3、Fe、H2SO4的物质的量之比为
1:2:4
1:2:4
.A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去). 
试回答:
(1)若X是强氧化性气体单质,则A可能是
a.C b.Al c.Na d.Mg
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在A中燃烧产生棕黄色的烟.
①B的化学式为
②向C的溶液中加入氢氧化钠溶液,现象是
(3)若A、B、C均为含有同种金属元素的化合物,X是强酸或强碱,则B的化学式为
查看习题详情和答案>>

试回答:
(1)若X是强氧化性气体单质,则A可能是
ac
ac
(填序号).a.C b.Al c.Na d.Mg
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在A中燃烧产生棕黄色的烟.
①B的化学式为
FeCl3
FeCl3
;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程表示)2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+
2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+
.②向C的溶液中加入氢氧化钠溶液,现象是
产生白色沉淀,迅速变成灰绿色,最终变为红褐色沉淀
产生白色沉淀,迅速变成灰绿色,最终变为红褐色沉淀
,写出涉及到的氧化还原反应的化学方程4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(3)若A、B、C均为含有同种金属元素的化合物,X是强酸或强碱,则B的化学式为
Al(OH)3
Al(OH)3
,反应②的离子方程式为Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+3H+=Al3++3H2O
.