摘要:22.在两支分别盛有Al(OH)3的试管中.向其中一支中滴加足量盐酸.观察到的现象是 .发生反应的离子方程式为 ,向另一支中滴加足量NaOH溶液.观察到的现象是 .发生反应的离子方程式为 .由此说明Al(OH)3是一种 氢氧化物.
网址:http://m.1010jiajiao.com/timu3_id_422847[举报]
(2010?南开区二模)下列实验操作或对实验事实的叙述正确的是
①用稀HNO3清洗做过银镜反应实验的试管
②用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
③读取滴定管内液体的体积,俯视读数导致读数偏小
④不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
⑤向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸,以制备Fe(OH)3胶体
⑥向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/L AgNO3
溶液,振荡,沉淀呈黄色
(2)某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
①按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式):
置换反应
化合反应
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:
查看习题详情和答案>>
①③④⑥
①③④⑥
(填序号).①用稀HNO3清洗做过银镜反应实验的试管
②用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
③读取滴定管内液体的体积,俯视读数导致读数偏小
④不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
⑤向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸,以制备Fe(OH)3胶体
⑥向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/L AgNO3
溶液,振荡,沉淀呈黄色
(2)某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[其主要成分为Cu2(OH)2CO3] |
置换反应
2Al+6H+═2Al3++3H2↑ 或2Al+3Cu2+═2Al3++3Cu
2Al+6H+═2Al3++3H2↑ 或2Al+3Cu2+═2Al3++3Cu
化合反应
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
.②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是
有白色沉淀生成,后沉淀逐渐溶解至消失
有白色沉淀生成,后沉淀逐渐溶解至消失
,解释此现象的离子方程式是Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O
Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是
CuO对H2O2的分解有催化作用
CuO对H2O2的分解有催化作用
.②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:
水槽(或集气瓶)、导管、量筒、秒表
水槽(或集气瓶)、导管、量筒、秒表
.
某化学兴趣小组的同学在学习了《铝 金属材料》一节后,产生了浓厚的实验探究兴趣,欲对氢氧化铝的化学性质进行实验探究。请你帮助他们完成实验方案和记录并回答有关的问题。
实验目的
1.观察氢氧化铝与酸、碱的反应,认识氢氧化铝的特性。
2.提高实验能力,增强探究意识。
实验原理
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=[Al(OH)4]-
实验药品和仪器
1mol?L-1 Al2(SO4)3溶液、10%NaOH溶液、浓氨水、稀盐酸、试管、胶头滴管
实验探究
1.在一支盛有l mol?L-1Al2(SO4)3溶液的大试管中逐滴加入浓氨水,直到产生大量沉淀。
2.将上述沉淀分为三份盛在三个试管中,分别进行如下实验:
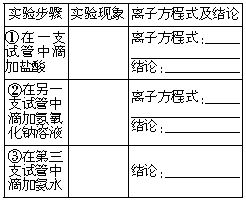
实验结论
1.通过实验探究,综合上述实验步骤①、②、③中的实验结论,你认为氢氧化铝具有___________,且氢氧化铝___________。
2.制取氢氧化铝时,用_________好。
讨论与思考
请你写出硫酸铝溶液与适量或过量氢氧化钠溶液反应时的化学方程式:______________________;________________________。
画出物质之间的物质的量的关系图:

拓展思考:查阅资料,试解释氢氧化铝为什么既能溶解在强酸溶液中,又能溶解在强碱溶液中,属于两性氢氧化物? 查看习题详情和答案>>
实验目的
1.观察氢氧化铝与酸、碱的反应,认识氢氧化铝的特性。
2.提高实验能力,增强探究意识。
实验原理
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=[Al(OH)4]-
实验药品和仪器
1mol?L-1 Al2(SO4)3溶液、10%NaOH溶液、浓氨水、稀盐酸、试管、胶头滴管
实验探究
1.在一支盛有l mol?L-1Al2(SO4)3溶液的大试管中逐滴加入浓氨水,直到产生大量沉淀。
2.将上述沉淀分为三份盛在三个试管中,分别进行如下实验:

实验结论
1.通过实验探究,综合上述实验步骤①、②、③中的实验结论,你认为氢氧化铝具有___________,且氢氧化铝___________。
2.制取氢氧化铝时,用_________好。
讨论与思考
请你写出硫酸铝溶液与适量或过量氢氧化钠溶液反应时的化学方程式:______________________;________________________。
画出物质之间的物质的量的关系图:

拓展思考:查阅资料,试解释氢氧化铝为什么既能溶解在强酸溶液中,又能溶解在强碱溶液中,属于两性氢氧化物? 查看习题详情和答案>>