网址:http://m.1010jiajiao.com/timu3_id_421989[举报]
(10分)CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) 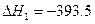 kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) 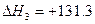 kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的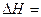 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。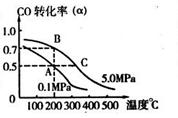
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) ![]() kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) ![]() kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的![]() 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,
在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(![]() )
)
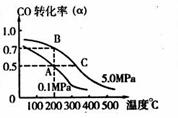
与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,
则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
查看习题详情和答案>>CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) ![]() kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) ![]() kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的![]() 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(![]() )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。
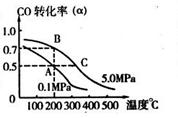
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
查看习题详情和答案>>(1)已知: C(s)+O2(g)
 kJ·mol-1
kJ·mol-1C(a)+H2O(g)
 kJ·mol-1
kJ·mol-1则反应CO(g)+H2(g)+O2(g)
 。
。(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)
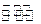 CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
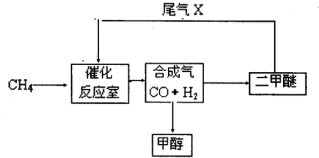
(1)写出用合成气生产二甲醚的化学方程式______.
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)?CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式______.
(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3(g)+H2O(g)△H2
①下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②已和:CH3OH(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则△H2=______.
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池.写出该电池负极的电极反应式______.