摘要:23. 第三周期ⅠA族 (2)H2O>NH3>H2S (3)Na+ Na+ △ ②H++HSO3- H2O+SO2↑ (5)S2-+H2O2+2H+ S↓+2H2O
网址:http://m.1010jiajiao.com/timu3_id_421711[举报]
据元素周期表及周期律的知识回答下列问题:
(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.
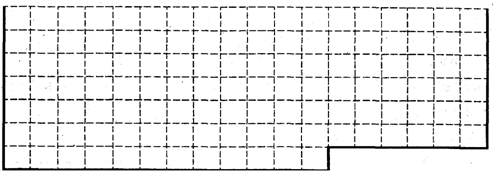
(2)下列比较元素性质的递变规律正确的是 .
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4 d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式 .工业上可用MnSO4溶液吸收氯气,获得Mn2O3,请写出该化学反应的化学方程式 .
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱 .
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式 .
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是 .
查看习题详情和答案>>
(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.

(2)下列比较元素性质的递变规律正确的是
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4 d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是
据元素周期表及周期律的知识回答下列问题:
(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.
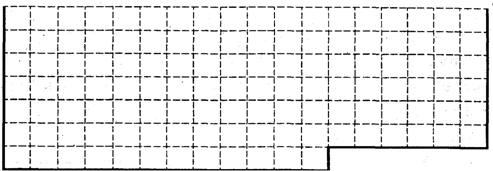
(2)下列比较元素性质的递变规律正确的是______.
a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式______.工业上可用MnSO4溶液吸收氯气,获得Mn2O3,请写出该化学反应的化学方程式______.
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱______.
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式______.
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是______.
查看习题详情和答案>>
(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.

(2)下列比较元素性质的递变规律正确的是______.
a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式______.工业上可用MnSO4溶液吸收氯气,获得Mn2O3,请写出该化学反应的化学方程式______.
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱______.
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式______.
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是______.