摘要:2.氯水用于消毒是因为 A.氯水中含有氯分子 B.氯水中含有次氯酸分子 C.氯水中含有氯离子 D.氯水中含有氢离子
网址:http://m.1010jiajiao.com/timu3_id_421354[举报]
A、B、C、D、E、F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
请回答下列问题:
(1)写出A与E形成的化合物的电子式 .
(2)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是
(3)F的盐酸盐水溶液呈酸性,原因是 (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是
(4)化合物M是一种元素C的+6含氧酸钾盐,常用作净水剂与消毒剂.由元素C稳定的氢氧化物与次氯酸钾、氢氧化钾溶液反应制取化合物M,则制备M的离子反应方程式是 . 查看习题详情和答案>>
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的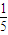 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)写出A与E形成的化合物的电子式 .
(2)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是
(3)F的盐酸盐水溶液呈酸性,原因是 (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是
(4)化合物M是一种元素C的+6含氧酸钾盐,常用作净水剂与消毒剂.由元素C稳定的氢氧化物与次氯酸钾、氢氧化钾溶液反应制取化合物M,则制备M的离子反应方程式是 . 查看习题详情和答案>>
海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用.
(1)下列有关海水综合利用的说法中正确的是
A.只需通过物理变化,可从海水中得到钾单质
B.海水通过蒸发可得到淡水,通过蒸馏可得到粗盐
C.从海水中可制取溴及其化工产品
D.利用潮汐发电是将化学能转化为电能
(2)写出工业上用MgCl2制备金属镁的化学方程式
(3)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可制备多种化工产品.
①用石墨电极电解饱和食盐水时,阳极的电极反应式是
②利用惰性电极电解饱和食盐水,可制备“84”消毒液(主要成分是NaClO).通电时阳极产生的气体被溶液完全吸收,若所得消毒液仅含一种溶质,电解的总化学方程式是
(4)工业上利用一定的装置电解K2SO4溶液可制取H2、O2、H2SO4、KOH.若将这些产物组成氢氧燃料电池,则电池负极的电极反应方程式为
查看习题详情和答案>>
(1)下列有关海水综合利用的说法中正确的是
C
C
.A.只需通过物理变化,可从海水中得到钾单质
B.海水通过蒸发可得到淡水,通过蒸馏可得到粗盐
C.从海水中可制取溴及其化工产品
D.利用潮汐发电是将化学能转化为电能
(2)写出工业上用MgCl2制备金属镁的化学方程式
MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||
(3)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可制备多种化工产品.
①用石墨电极电解饱和食盐水时,阳极的电极反应式是
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.②利用惰性电极电解饱和食盐水,可制备“84”消毒液(主要成分是NaClO).通电时阳极产生的气体被溶液完全吸收,若所得消毒液仅含一种溶质,电解的总化学方程式是
NaCl+H2O
NaClO+H2↑
| ||
NaCl+H2O
NaClO+H2↑
.“84”消毒液在常温下的pH
| ||
>
>
7,用离子方程式表示其原因ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
.(4)工业上利用一定的装置电解K2SO4溶液可制取H2、O2、H2SO4、KOH.若将这些产物组成氢氧燃料电池,则电池负极的电极反应方程式为
H2-2e-+2OH-=2H2O或H2-2e-=2H+
H2-2e-+2OH-=2H2O或H2-2e-=2H+
. “84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.
“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.