摘要:某温度时.把1molN2O4气体通入体积为10L的真空密闭容器中.立即出现棕色.反应进行4s时NO2的浓度为0.04mol/L.再经过一定时间后.反应到达平衡.这时容器内压强为开始时的1.8倍.则下列说法正确的是 A 前4s中以N2O4的浓度变化表示的平均反应速度为0.01mol/L·s B 在4s时容器内的压强为开始时的1.2倍 C 在平衡时容器内含N2O40.4mol D 在平衡时容器内含NO21.6mol 第Ⅱ卷
网址:http://m.1010jiajiao.com/timu3_id_42034[举报]
某温度时,把1molN2O4气体通入体积为10L的真空容器,立即出现红棕色,反应进行4s时,NO2的浓度为0.04mol/L,再经过一段时间后,反应达平衡,这时容器内压强为开始时的1.8倍.则下列说法正确的是( )
查看习题详情和答案>>
(8分)在某温度时,把 0.5mol N2O4 气体通入体积为5L的密闭容器中,2s时NO2的浓度为0.02mol.L-1,60s时达到平衡,此时容器内的压强为开始时的1.6倍。试回答下列各问题:
(1)2s时用N2O4浓度变化表示的化学反应速率是_________________。
(2)2s时,体系内的压强为开始时的 ________倍,此时N2O4的分解率为_______。
(3)达到平衡时,平衡混合物中N2O4的物质的量为____________,
查看习题详情和答案>>
已知NO2和N2O4可以相互转化: N2O4 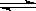 2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s
(2)在4s时容器内的压强为开始时的 倍
(3)在平衡时容器内含N2O4 mol
(4)在平衡时容器内NO2的浓度为 mol/L
(5)平衡时N2O4的转化率为