摘要:25.A.B.C.D.E.F是周期表前30号元素中的六种元素.它们的原子序数依次增大.三种为金属元素.三种为非金属元素.常温下.A.E两种元素所形成的常见单质为气体.B.C.D.F四种元素所形成的常见单质为固体.实验室通常将B单质保存在煤油中.单质B与单质A因反应条件不同生成两种不同的化合物甲和乙.C和E元素的原子均只有一个未成对P电子.D和F两元素形成的某种化合物是硫酸工业的常用原料. 回答下列问题: (1)F元素在周期表中的位置为 .F原子基态时核外电子排布式 . (2)甲.乙均能与水反应.但甲与水发生的反应属于氧化还原反应.写出甲的电子式 .写出甲与水发生反应的化学方程式并标出电子转移的方向和数目: . (3)F的一种红褐色氢氧化物与E的单质.B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4.试写出该反应的化学反应方程式为: 26.有些香皂.洗发香波中往往有兰花香味.这是其中添加了化学式为C10H20O2的一种香料A.下列框图列出了生成该物质的原料及一系列反应.已知:D.E都能使石蕊变红.分子式相同.经分析E中有10个H原子.且只有两种不同的H原子.C无支链.既有氧化性又有还原性.F与B碳原子数相等. 结合框图和提示回答有关问题: (1)F可以发生的反应有 . ①加成反应 ②消去反应 ③加聚反应 ④氧化反应 ⑤还原反应 (2)E在甲基上的氢若被氧取代.其一氧代物有 种.将该一氧化物在NaOH溶液中加热.写出该反应的方程式: . (3)B.E.F分子所含的官能团的名称依次是 . . .设计实验检验C中的官能团 . 27.实验室用浓硫酸与铜的反应制取少量NaHSO3.实验装置如下图所示: 请回答: (1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热.至反应结束后.发现烧瓶中还有少量Cu剩余.有人认为还有一定量的H2SO4剩余.原因是 .在不增加浓H2SO4的前提下.若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质). (2)向反应后的溶液中加入足量的CuO.使剩余的H2SO4全部转化为CuSO4.过滤后将滤液加热浓缩.冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值, ①在他们的实验操作中至少称量 次. ②下面是其中一次实验的数据 坩埚质量 坩埚与晶体总质量 加热后坩埚与固体总质量 11.7g 22.7g 18.6g 根据上表数据计算判断x的实测值比理论值(x=5) . (3)装置乙的作用是: , (4)下列说法正确的是: . a.甲装置使用的玻璃仪器有:酒精灯.玻璃管.长颈漏斗.圆底烧瓶 b.KMnO4溶液用于尾气处理 c.当把品红溶液滴入到锥形瓶中.若品红不褪色.说明无NaHSO3产生 d.当把品红溶液滴入到锥形瓶中.若品红褪色.说明NaOH已完全转化为NaHSO3 e.若把品红溶液换成酸性高锰酸钾溶液.并滴入到锥形瓶中.不显紫红色.说明NaOH已完全转化为NaHSO3 f.此装置换上其它药品后.不能制取和收集少量纯净的氯气
网址:http://m.1010jiajiao.com/timu3_id_420245[举报]
A、B、C、D、E、F是周期表前30号元素中的六种元素,它们的原子序数依次增大,三种为金属元素、三种为非金属元素.常温下,A、E两种元素所形成的常见单质为气体,B、C、D、F四种元素所形成的常见单质为固体,实验室通常将B单质保存在煤油中,单质B与单质A因反应条件不同生成两种不同的化合物甲和乙.C和E元素的原子均只有一个未成对P电子.D和F两元素形成的某种化合物是硫酸工业的常用原料.
回答下列问题:
(1)F元素在周期表中的位置为
(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式
 ,写出甲与水发生反应的化学方程式并标出电子转移的方向和数目:
,写出甲与水发生反应的化学方程式并标出电子转移的方向和数目:
 .
.
(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:
查看习题详情和答案>>
回答下列问题:
(1)F元素在周期表中的位置为
第四周期第VIII族
第四周期第VIII族
,F原子基态时核外电子排布式1s22s22p43s23p43d44s2
1s22s22p43s23p43d44s2
.(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式




(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:
2Fe(OH)3+10NaOH+3Cl2=2Na2FeO4+6NaCl+8H2O
2Fe(OH)3+10NaOH+3Cl2=2Na2FeO4+6NaCl+8H2O
.
A、B、C、D、E、F是周期表前30号元素中的六种元素,它们的原子序数依次增大,三种为金属元素、三种为非金属元素.常温下,A、E两种元素所形成的常见单质为气体,B、C、D、F四种元素所形成的常见单质为固体,实验室通常将B单质保存在煤油中,单质B与单质A因反应条件不同生成两种不同的化合物甲和乙.C和E元素的原子均只有一个未成对P电子.D和F两元素形成的某种化合物是硫酸工业的常用原料.
回答下列问题:
(1)F元素在周期表中的位置为______,F原子基态时核外电子排布式______.
(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式______,写出甲与水发生反应的化学方程式并标出电子转移的方向和数目:______.
(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:______.
查看习题详情和答案>>
回答下列问题:
(1)F元素在周期表中的位置为______,F原子基态时核外电子排布式______.
(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式______,写出甲与水发生反应的化学方程式并标出电子转移的方向和数目:______.
(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:______.
查看习题详情和答案>>
所示框图涉及到的物质所含元素中,除一种元素外,其余均为元素周期表中前18号元素.其中A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出).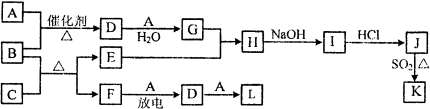
请回答下列问题:
(1)B的电子式为 .
(2)J、K是同种金属的不同氯化物,K为白色沉淀.写出SO2还原J生成K的离子方程式: .
(3)气体B在纯A中燃烧,可生成F和水.科学家利用此原理,设计成B-A燃料电池,则通入气体B的一极是 (填“正极”或“负极”);碱性条件下,该极的电极反应式为 .
(4)在80℃时,将0.80mol气体L充入2L已经抽空的固定容积的密闭容器中发生反应生成M,隔一段时间对该容器内的物质进行分析,得到如表数据:
①计算a= ,此温度时该反应的平衡常数K= ,
②改变条件使反应重新达到平衡,能使c(M)/c(L)值变小的措施有(填字母编号) .
A.增大L的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体.
查看习题详情和答案>>

请回答下列问题:
(1)B的电子式为
(2)J、K是同种金属的不同氯化物,K为白色沉淀.写出SO2还原J生成K的离子方程式:
(3)气体B在纯A中燃烧,可生成F和水.科学家利用此原理,设计成B-A燃料电池,则通入气体B的一极是
(4)在80℃时,将0.80mol气体L充入2L已经抽空的固定容积的密闭容器中发生反应生成M,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间/s | 0 | 30 | 60 | 90 |
| n(L)/mol | 0.80 | a | b | c |
| n(M)/mol | 0.00 | 0.10 | 0.20 | 0.20 |
②改变条件使反应重新达到平衡,能使c(M)/c(L)值变小的措施有(填字母编号)
A.增大L的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体.