网址:http://m.1010jiajiao.com/timu3_id_420082[举报]
(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为 ,B元素名称为 ;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为 .
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列4种物质熔、沸点由高到低排列为 (填序号).
①金刚石 ②晶体锗 ③晶体硅 ④金刚砂
(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为 ,B元素名称为 ;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为 .
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列4种物质熔、沸点由高到低排列为 (填序号).
①金刚石 ②晶体锗 ③晶体硅 ④金刚砂
查看习题详情和答案>>
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为 .
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列4种物质熔、沸点由高到低排列为 (填序号).
①金刚石 ②晶体锗 ③晶体硅 ④金刚砂
(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为 ,B的元素名称为 ;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是 ![]()
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311kJ·mol-1,则氢负离子H-的第一电离能为
查看习题详情和答案>>(1)可正确表示原子轨道的是 。
| A.2s | B.2d | C.2px | D.3f |
(3)下列物质变化,只与范德华力有关的是 。
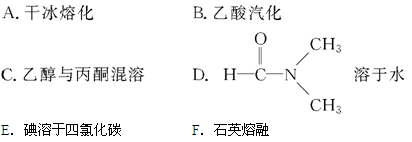
(4)下列物质中,只含有极性键的分子是 ,既含离子键又含共价键的化合物是 ;只存在σ键的分子是 ,同时存在σ键和π键的分子是 。
AN2;BCO2;CCH2Cl2;DC2H4;EC2H6;FCaCl2;GNH4Cl
(5)用“>”、“<”或“=”填空:
第一电离能的大小:Mg Al;熔点的高低:KCl MgO。 查看习题详情和答案>>