摘要:如图所示.将6mol X和3mol Y两种气体置于体积可变的等压容器中.在一定温度下发生下列反应: 反应达到平衡状态A时.测得气体总物质的量为6.6mol.若X.Y.Z的起始时物质的量分别用a.b.c表示.回答下列问题: (1)达到平衡状态A时.Y的转化率为 .在达到平衡状态A的容器中.通入少量Y.则体系中X的体积分数 .(填“增大 .“减小 或“不变 ) (2)若起始时a=3.2mol.且达到平衡后各气体的体积分数与平衡状态A相同.则起始时取值分别为b= .c= . (3)若要使反应开始时向逆反应方向进行.且达到平衡后各气体的物质的量分数与平衡状态A相同.则起始时c的取值范围是: .
网址:http://m.1010jiajiao.com/timu3_id_419023[举报]
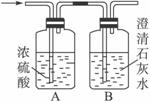
 如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是
H2
H2
.(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是
CO
CO
.(3)若A、B两个洗气瓶的质量都增加,则气体X可能是:
| ① | ② | ③ | ④ | ⑤ |
合成氨的反应原理为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为

(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,
②用相同浓度的盐酸中和两种溶液至中性,
③加水稀释两种溶液至pH为10,
查看习题详情和答案>>
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是
AD
AD
(填序号).A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为
33.3%
33.3%
;该条件下反应的平衡常数为0.5
0.5
.
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,
B
B
中水的电离程度大.(填序号,下同)②用相同浓度的盐酸中和两种溶液至中性,
A
A
消耗的盐酸多.③加水稀释两种溶液至pH为10,
A
A
加入的水的体积大.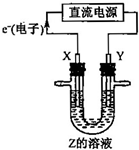 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )