摘要:20.将0.2mol/LHCN溶液和0.1mol/LNaOH溶液等体积混合后.溶液显碱性.下列关系式中不正确的是: A.C(HCN)< C(CN-) B.C(Na+) > C(CN-) C.C(HCN)- C(CN-)= 2C(OH-)-2(H+) D.C(HCN)+ C(CN-)= 0.1mol/L
网址:http://m.1010jiajiao.com/timu3_id_418382[举报]
将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
[ ]
A. [HCN]<[CN-]
B. [Na+]>[CN-]
C. [HCN]-[CN-]=[OH-]
D. [HCN]+[CN-]=0.1mol/L
查看习题详情和答案>>
B. [Na+]>[CN-]
C. [HCN]-[CN-]=[OH-]
D. [HCN]+[CN-]=0.1mol/L
(1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
)+c(NH3?H2O)一定等于
②溶液中n(OH-)+n(Cl-)-n(NH+4)=
查看习题详情和答案>>
C(Na+)>C(CN-)>C(OH-)>C(H+)
C(Na+)>C(CN-)>C(OH-)>C(H+)
.(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
+ 4 |
0.02mol/L
0.02mol/L
②溶液中n(OH-)+n(Cl-)-n(NH+4)=
n(Na+)+n(H+)
n(Na+)+n(H+)
.
(1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为 .
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH )+c一定等于
)+c一定等于
②溶液中n(OH-)+n(Cl-)-n(NH+4)= . 查看习题详情和答案>>
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
 )+c一定等于
)+c一定等于 ②溶液中n(OH-)+n(Cl-)-n(NH+4)= . 查看习题详情和答案>>
(1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为______.
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
)+c(NH3?H2O)一定等于______
②溶液中n(OH-)+n(Cl-)-n(NH+4)=______.
查看习题详情和答案>>
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
| +4 |
②溶液中n(OH-)+n(Cl-)-n(NH+4)=______.
 (2011?丹东模拟)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
(2011?丹东模拟)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol,2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=一1135.7kJ/mol.则肼完全燃烧的热化学方程式为
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
.(2)肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,正极的电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
,电池工作一段时间后,电解质溶液的pH将减小
减小
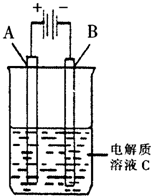
(填“增大”、“减小”、“不变”).(3)如图是一个电化学装置示意图.用肼--空气燃料电池做此装置的电源.
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4.该装置的实际意义是
精炼粗铜
精炼粗铜
.②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗
0.025
0.025
molN2H4.(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因
N2H4+H2O N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH-
 N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH-N2H4+H2O N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH-
. N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH-(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4?H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)
大于
大于
0.1mol/LHCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”).(6)已知:在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H-5、Cl-、OH-、H+离子浓度南大到小的顺序为
c(N2H+5)>c(Cl-)>c(OH-)>c(H+)
c(N2H+5)>c(Cl-)>c(OH-)>c(H+)
.