网址:http://m.1010jiajiao.com/timu3_id_417569[举报]
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中
FeO(s)+CO(g) Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
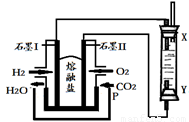
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
查看习题详情和答案>>
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。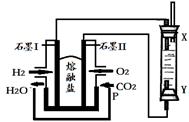
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
 铁元素及其化合物与人类的生产生活息息相关,
铁元素及其化合物与人类的生产生活息息相关,
试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式______.
(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g).
已知:Fe(s)+ O2(g)═FeO(s)△H=-272kJ?mol-1
O2(g)═FeO(s)△H=-272kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-22lkJ?mol-1
则:①FeO(s)+CO(g)?Fe(s)+CO2(g)△H=______.
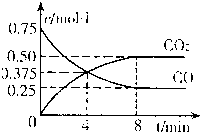
②一定温度下,向某密闭容器中加人足量FeO,并充人一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,v(CO)=______;该温 度下,FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数K=______.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______.
查看习题详情和答案>>
试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式______.
(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g).
已知:Fe(s)+
| 1 |
| 2 |
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-22lkJ?mol-1
则:①FeO(s)+CO(g)?Fe(s)+CO2(g)△H=______.
②一定温度下,向某密闭容器中加人足量FeO,并充人一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,v(CO)=______;该温 度下,FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数K=______.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______.
(1)铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+.
①铁酸钠中铁元素的化合价为______.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:______.(用离子方程式表示)
(2)反应ⅠFe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g)△H=b kJ?mol-1测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②反应Ⅰ中的a______0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO2起始浓度为2mol?L-1,CO的平衡浓度为______mol?L-1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有______(填序号).
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=______kJ?mol-1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______g.