网址:http://m.1010jiajiao.com/timu3_id_417491[举报]
合成氨反应:N2(g)+3H2(g)
(1)若该反应在一定条件下能自发,则该反应的△H
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成n mol N2的同时生成2n molNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)=
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表的①②处填入合适的实验条件数据.
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) | 平衡时NH3百分含量 |
| ⅰ | 450 | 1/3 | 1 | |
| ⅱ | ① | 1/3 | ② | |
| ⅲ | 480 | 1/3 | 10 |
(15分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol, NN键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下, 反应达到平衡的时间为: ,其化学平衡常数K= ;达到平衡后氨气的转化率为: 。
查看习题详情和答案>>
(12分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。合成氨反应:N2(g)+3H2(g) 2NH3(g)△H
2NH3(g)△H
(1)若该反应在一定条件下能自发,则该反应的△H 0、△S 0(填“<”、“>”或“=”)。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是 。
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间内生成n mol N2的同时生成2n molNH3 |
| C.混合气体的密度不再改变 |
| D.容器内压强不随时间的变化而变化 |
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表的①②处填入合适的实验条件数据。
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) | 平衡时NH3百分含量 |
| ⅰ | 450 | 1/3 | 1 | |
| ⅱ | ① | 1/3 | ② | |
| ⅲ | 480 | 1/3 | 10 | |
(12分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
合成氨反应: N2(g)+3H2(g) 2NH3(g) △H
2NH3(g) △H
(1)若该反应在一定条件下能自发,则该反应的△H 0、△S 0(填“<”、“>”或“=”)。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是 。
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表的①②处填入合适的实验条件数据。
|
实验编号 |
T(℃) |
n (N2)/n(H2) |
P(MPa) |
平衡时NH3百分含量 |
|
ⅰ |
450 |
1/3 |
1 |
|
|
ⅱ |
① |
1/3 |
② |
|
|
ⅲ |
480 |
1/3 |
10 |
|
查看习题详情和答案>>
(15分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol, N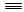 N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是
反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是
反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下, 反应达到平衡的时间为: ,其化学平衡常数K= ;达到平衡后氨气的转化率为: 。
查看习题详情和答案>>