网址:http://m.1010jiajiao.com/timu3_id_417368[举报]
| 元素 | A | B | C | D | 性质、结构信息 | 价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定. | 基态原子的M层有1对成对的p电子. | 第三周期中电离能最小的元素. | 原子L电子层上s电子数等于p电子数. 单质为空间网状晶体,具有很高的熔、沸点. |
(2)元素A形成的气态氢化物的空间构型为
(3)元素B的氢化物熔点比水低,原因是
(4)元素B和C形成的化合物属于
(5)元素D形成的化合物D2H2属于
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
![]() ⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);
在②的分子中有 个σ键和 个π键。
查看习题详情和答案>>四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质、结构信息 | 价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定。 | 基态原子的M层有1对成对的p电子。 | 第三周期中电离能最小的元素。 | 原子最外电子层上s电子数等于p电子数。 其一种单质为自然界中硬度最大的非金属单质。 |
(1)写出元素B基态原子的电子排布图 。
(2)元素A形成的气态氢化物的空间构型为 。(3)元素B和C形成的化合物的电子式是 。
(4)元素D形成的化合物D2H2属于 (填“极性”或“非极性”)分子。
(5)A、C、D三种元素的电负性由小到大的顺序是_________(用元素符号表示)。
查看习题详情和答案>>
(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
⑶D元素的某价态阳离子可与KCN溶液形成一种俗称黄血盐的配合物甲,甲的化学式可表示为K4[D(CN)6],则中心原子D的化合价为 ,甲在水溶液中的电离方程式为 ;已知D元素的另一种价态的离子可与KCN溶液形成另一种配合物乙,乙的配位数与甲相同,则乙的化学式为 。
![]() ⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子没有采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键。
查看习题详情和答案>>
(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。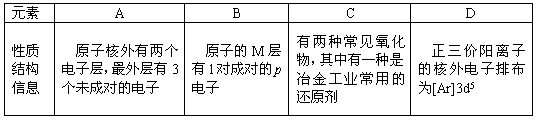
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
⑶D元素的某价态阳离子可与KCN溶液形成一种俗称黄血盐的配合物甲,甲的化学式可表示为K4[D(CN)6],则中心原子D的化合价为 ,甲在水溶液中的电离方程式为 ;已知D元素的另一种价态的离子可与KCN溶液形成另一种配合物乙,乙的配位数与甲相同,则乙的化学式为 。 ⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。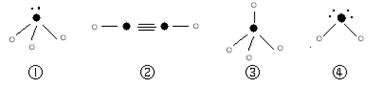
则在以上分子中,中心原子没有采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键。