网址:http://m.1010jiajiao.com/timu3_id_417043[举报]
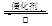 2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
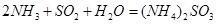
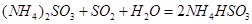
下列措施中能提高燃煤烟气中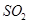 去除率的有
(填字母)。
去除率的有
(填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
查看习题详情和答案>>
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
下列措施中能提高燃煤烟气中去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
查看习题详情和答案>>
SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为: 2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气
⑶若2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
A.Q1 = 2Q2 = 2Q3 = 197kJ
B.在上述反应中每消耗2mol SO2气体时放出的热量为197kJ
C.在上述反应中生成1mol SO3气体放热98.5kJ
D.2Q1 ??= 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
![]()
![]()
下列措施中能提高燃煤烟气中![]() 去除率的有 (填字母)。
去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
查看习题详情和答案>>
(1)该反应的化学平衡常数表达式为K=
| c2(C) |
| c(A)×c(B) |
| c2(C) |
| c(A)×c(B) |
(2)若25min、35min时的化学平衡常数分别为K1、K2,则二者的大小关系是
(3)在甲、乙、丙三个相同的密闭容器中按表中所述投料,在恒温、恒容的条件下进行反应,平衡后测得A的浓度如表中所示:
| 容器 | 甲 | 乙 | 丙 |
| 起始投料 | 1molA和1molB | 2molC | 2molA和2molB |
| A的平衡浓度 | C1 | C2 | C3 |
| A、1:1:1 | B、3:2:1 | C、1:2:3 | D、2:3:6 |