网址:http://m.1010jiajiao.com/timu3_id_416944[举报]
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可以利用的资源,其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).一定条件下其化学方程式为:
![]()
请填空:
(1)写出上述反应的平衡常数表达式K:________.
(2)在容积为2 L的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实验结果如下图所示.下列说法正确的是(填序号)________.
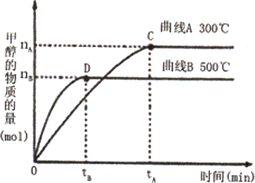
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=nA/tAmol·(L·min)-1
B.反应体系从300℃升温到500℃,平衡常数K变大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升温到500℃ n(H2)/n(CH3OH)增大
(3)25℃,1.01×105 Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为________.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是________正极的电极方程式为________.
(1)甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
A 甲+H2O
| ||
B 乙
| ||
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表里的位置是
②若甲为某短周期金属元素的氯化物,则甲发生A反应的化学方程式为
| ||
| ||
③将以上两种金属单质用导线连接,插入NaOH溶液构成原电池,则负极发生的电极反应为
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
| ||
①甲的结构式为
②写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式
(2)标准状况下,11.2L氧气的物质的量为
(3)某生欲用 2mol/LNaOH溶液配制0.1mol/LNaOH溶液100mL,需量取2mol/LNaOH溶液的体积为
(4)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,ACl2的摩尔质量是
(1)若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O
| △ |
| △ |
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是:
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:
| ||
| ||
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
| 高温 |
①甲的结构式为
②写出上述反应的化学方程式
| ||
| ||
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式
(10分)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
A 甲+H2O 乙+丙 B 乙
乙+丙 B 乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表里的位置是_____________。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为__________。
③将以上两种金属单质用导线连接,插入NaOH溶液构成原电池,则负极发生的电极反应为___________________________。
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①甲的结构式为_____________。
②写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式________________________。