摘要:氢氧化物 NaOH Al(OH)3 Fe(OH)2 Fe(OH)3 属性 碱性氢氧化物 两性氢氧化物 碱性氢氧化物 碱性氢氧化物 与酸反应 与碱反应 不反应 不反应 不反应 热稳定性 稳定 受热分解 还原性 无还原性 无还原性 无还原性 制备 略 用途 化工原料 脱色净水中和胃酸 净水 净水 学 生 课 堂 笔 记
网址:http://m.1010jiajiao.com/timu3_id_41675[举报]
二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。

(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
氢氧化物 | Fe(OH)3 | A1(OH)3 |
开始沉淀pH | 1.5 | 3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是 ,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO2(g)==C(s)+O2(g); △H =393.5 kJ?mol-l
②CO(g)+ O2(g)==CO2(g); △H =-283 kJ?mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H =141 kJ?mol-l
写出TiO2与Cl2+C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
查看习题详情和答案>>镍电池由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境 有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
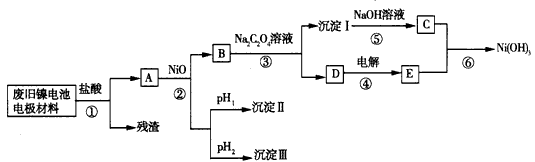
已知:
①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:

回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ:____和沉淀Ⅱ:____(填化 学式),则pH1____pH2(填“>”、“=”或“<”)。
(2)已知溶解度:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O,则步骤③中反应的化学方程式是_______。第③步反应后,过滤沉淀I所需的玻璃仪器有___。
(3)步骤④中阳极反应产生的气体E为一黄绿色气体,写出步骤⑥中反应的离子方程式___
(4) FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则 c(Fe3+)/c(Al3+)=____。
查看习题详情和答案>>
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ:____和沉淀Ⅱ:____(填化 学式),则pH1____pH2(填“>”、“=”或“<”)。
(2)已知溶解度:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O,则步骤③中反应的化学方程式是_______。第③步反应后,过滤沉淀I所需的玻璃仪器有___。
(3)步骤④中阳极反应产生的气体E为一黄绿色气体,写出步骤⑥中反应的离子方程式___
(4) FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则 c(Fe3+)/c(Al3+)=____。
欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
(1)某含铬废水处理的主要流程如图所示: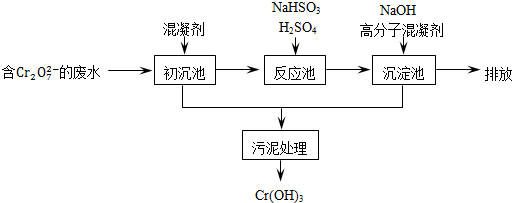
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
查看习题详情和答案>>
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |

①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是8.48
8.48
g.蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Mg、Fe、Al和Si.
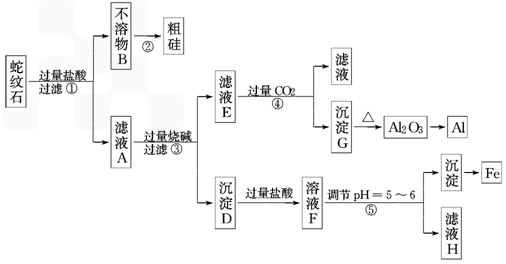
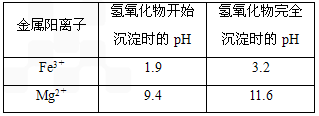
有关氢氧化物沉淀时的pH见下表
请回答下列问题:
(1)滤液A中含有的阳离子有___________________________________.
(2)操作②中涉及的化学方程式为_____________________________________________,操作④中生成沉淀G的离子方程式为_________________________________________.
(3)操作⑤中调节pH为5~6时,可以用到的试剂为(填序号)________.
a.NaOH溶液 b.氨水 c.MgO d.Mg(OH)2
(4)由滤液H制取金属Mg的流程如下
(1)滤液A中含有的阳离子有___________________________________.
(2)操作②中涉及的化学方程式为_____________________________________________,操作④中生成沉淀G的离子方程式为_________________________________________.
(3)操作⑤中调节pH为5~6时,可以用到的试剂为(填序号)________.
a.NaOH溶液 b.氨水 c.MgO d.Mg(OH)2
(4)由滤液H制取金属Mg的流程如下
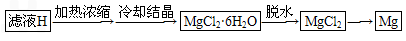
该流程中由MgCl2冶炼Mg的方法是________.在干燥的HCl气流中加热MgCl2·6H2O制取无水氯化镁的原因是__________________.
查看习题详情和答案>>
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si.
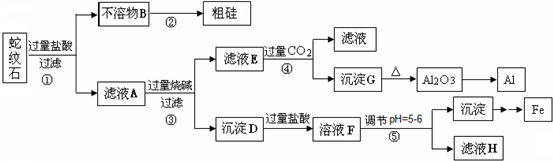
有关氢氧化物沉淀的pH见下表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有______.
(2)操作②中涉及的化学方程式为______,
操作④中生成沉淀G的离子方程式为______.
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)______.
a.NaOH溶液 b.氨水 c.MgO d.Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:
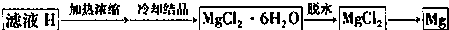
流程中由MgCl2冶炼Mg的方法是______.在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是______. 查看习题详情和答案>>