摘要: (1)SO2+MnO2=MnSO42Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 氢氧化铁.氢氧化铝.硫酸钙
网址:http://m.1010jiajiao.com/timu3_id_416524[举报]
减少SO2的排放、回收利用SO2成为世界性的研究课题.我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
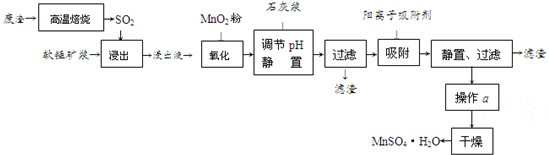
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.
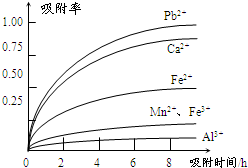
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图.
 已知PbO2的氧化性大于MnO2.请回答下列问题:
已知PbO2的氧化性大于MnO2.请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式
(2)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至
(3)阳离子吸附剂用于除去杂质金属离子.决定阳离子吸附剂吸附效果的因素是
a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸附时间
(4)操作a包括
查看习题详情和答案>>

浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图.
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
 已知PbO2的氧化性大于MnO2.请回答下列问题:
已知PbO2的氧化性大于MnO2.请回答下列问题:(1)写出浸出过程中主要反应的化学方程式
SO2+MnO2=MnSO4
SO2+MnO2=MnSO4
,氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
.(2)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至
4.7~8.3
4.7~8.3
.(3)阳离子吸附剂用于除去杂质金属离子.决定阳离子吸附剂吸附效果的因素是
b、c、d
b、c、d
(填写序号).a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸附时间
(4)操作a包括
蒸发、浓缩、结晶
蒸发、浓缩、结晶
等过程.(2011?常州三模)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2=MnSO4 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是
查看习题详情和答案>>

已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH
小
小
(填“大”或“小”),该流程可与工业制备硫酸
工业制备硫酸
(填工业生产名称)联合,生产效益更高.(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
,这样设计的目的和原理是使Fe2+转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)
使Fe2+转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀
与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀
.(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是
使MnCO3沉淀完全
使MnCO3沉淀完全
,溶液的pH不能过低的原因是MnCO3沉淀量少,NH4HCO3与酸反应
MnCO3沉淀量少,NH4HCO3与酸反应
.(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是
节约能源、治理含SO2的工业废气等
节约能源、治理含SO2的工业废气等
.(答对1个即可)(2013?泰安二模)工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4?H2O),其主要流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为
(2)浸出液中加入MnO2粉末的目的是
(3)溶液中加入石灰浆来调节pH,其作用是
(4)滤渣的主要成分是
查看习题详情和答案>>

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
SO2+MnO2=MnSO4
SO2+MnO2=MnSO4
.(2)浸出液中加入MnO2粉末的目的是
将Fe2+氧化为Fe3+
将Fe2+氧化为Fe3+
;反应的离子方程式是2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
.(3)溶液中加入石灰浆来调节pH,其作用是
使Fe3+Al3+完全沉淀
使Fe3+Al3+完全沉淀
;pH应调节的范围是4.7≤pH≤8.3
4.7≤pH≤8.3
.(4)滤渣的主要成分是
Fe(OH)3、Al(OH)3、CaSO4
Fe(OH)3、Al(OH)3、CaSO4
(用化学式表示).(2010?宜宾模拟)为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:
(2)写出氧化过程中主要反应的离子方程式:
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至
(4)滤渣的主要成分有
(5)下列各组试剂中,能准确测定尾气中SO2含量的是
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3废气,可得到硫酸锰晶体质量为
查看习题详情和答案>>

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:
SO2+MnO2=MnSO4
SO2+MnO2=MnSO4
.(2)写出氧化过程中主要反应的离子方程式:
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
.(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至
4.7~8.3
4.7~8.3
.(4)滤渣的主要成分有
氢氧化铁、氢氧化铝、硫酸钙
氢氧化铁、氢氧化铝、硫酸钙
.(5)下列各组试剂中,能准确测定尾气中SO2含量的是
bc
bc
.(填编号)a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3废气,可得到硫酸锰晶体质量为
15.21kg
15.21kg
kg.(2011?江西二模)为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:
(2)写出氧化过程中主要反应的离子方程式:
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是
(4)滤渣的主要成分有
(5)下列各组试剂中,能准确测定尾气中SO2含量的是
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液.
查看习题详情和答案>>

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:
SO2+MnO2=MnSO4
SO2+MnO2=MnSO4
.(2)写出氧化过程中主要反应的离子方程式:
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
.(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是
4.7~8.3
4.7~8.3
.(4)滤渣的主要成分有
氢氧化铁、氢氧化铝、硫酸钙
氢氧化铁、氢氧化铝、硫酸钙
.(5)下列各组试剂中,能准确测定尾气中SO2含量的是
b、c
b、c
.(填编号)a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液.