网址:http://m.1010jiajiao.com/timu3_id_416114[举报]


(2)请用物质的名称填写.
硬度最大的是单质是
(3)在原子序数为1~18号元素中,请用化学式填写.
与水反应最剧烈的金属单质是
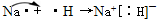
(4)在原子序数为1~18号元素中,请按要求填写下列空白.
由两种元素组成的淡黄色化合物的电子式为




(2)请用物质的名称填写.
硬度最大的是单质是 ,密度最小的金属是 ;通常状况呈液态的非金属单质是 ,地壳中含量最多的金属元素是 .
(3)在原子序数为1~18号元素中,请用化学式填写.
与水反应最剧烈的金属单质是 ;元素的气态氢化物最稳定的是 ;元素的最高价氧化物所对应的水化物其酸性最强的是 ;原子半径最大的金属与原子半径最小的非金属形成的化合物是 ,并用电子式表示其形成过程: .
(4)在原子序数为1~18号元素中,请按要求填写下列空白.
由两种元素组成的淡黄色化合物的电子式为 ;空气中含量最高的物质的结构式为 ;常温下为气态,固态常用于人工降雨的氧化物的电子式为 ;某元素最高价氧化物的水化物与其气态氢化物反应生成一种盐,该盐的化学式为 ,该化合物中的化学键类型是 . 查看习题详情和答案>>
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
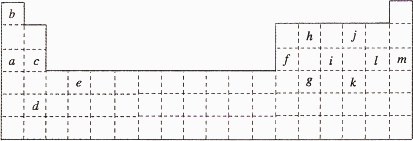
(1)①请用粗实线在上图中画出金属元素与非金属元素的分界线.
②写出g元素在周期表中的位置:________________.
(2)下列________(填写编号)组元素的单质可能都是电的良导体.
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(3)现有下列短周期元素性质的数据:
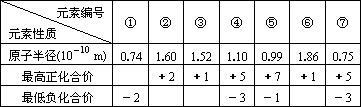
试回答下列问题:
Ⅰ.上述元素中①、②、⑥分别为________,上述元素中处于第二周期的有________(以上均用元素符号表示).
Ⅱ.元素④与元素⑦相比较,气态氢化物较稳定的是________(填化学式).
Ⅲ.工业上主要获取⑤的单质的化学反应方程式为:________.
Ⅳ.⑤和⑥形成的化合物中化学键是________________.
某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H?2密度的8.5倍。
请回答:
(1)乙的电子式为 。
(2)甲具有不稳定性,其发生分解的化学反应方程式为 。
实验室保存甲的方法是 。
(3)在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是
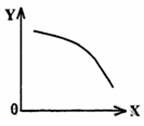 (选填字母)
(选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体的密度
d.当X表示乙的物质的量时,Y表示某一生成物的物质的量
(4)现有硫酸甲的混合液20mL,其中硫酸的物质的量浓度为2mol?L―1,甲的物质的量浓度为1mol?L-1。向该混合液中加入0.96g铜粉,假设只生成一种无色气体,则所收集到的气体的体积在标准状况下为 。
(5)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(结合离子方程式简要说明) 。
查看习题详情和答案>>| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④
b.与元素④所形成的单质互为等电子体的分子、离子的化学式
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质.则其负极反应式为
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子.0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 已知该原子的半径为d,相对原子质量为M,NA代表阿伏加德罗常数,请回答:

晶体中该原子的配位数为
| M | ||
4
|
| M | ||
4
|