摘要:14.已知:2H2,△H = -571.6 kJ•mol-1 CH4+2H2O(l),△H = -890 kJ•mol-1 现有H2与CH4的混合气体112 L.使其完全燃烧生成CO2和H2O(l).若实验测得反应放热3 695 kJ.则原混合气体中H2与CH4的物质的量之比是( ) A.1:1 B.1:3 C.1:4 D.2:3
网址:http://m.1010jiajiao.com/timu3_id_416015[举报]
已知:2H2(g)+O2(g)  2H2O(l);ΔH=-571.6 kJ· mol-1? CO(g)+
2H2O(l);ΔH=-571.6 kJ· mol-1? CO(g)+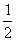 O2(g)
O2(g) CO2(g);ΔH=-282.8kJ· mol-1,现有CO、H2和CO2组成的混合气体
CO2(g);ΔH=-282.8kJ· mol-1,现有CO、H2和CO2组成的混合气体67.2 L (标准状况)经完全燃烧后放出的总热量为710.0 kJ,并生成18 g 液态水。则燃烧前混合气体中CO的体积分数为 ( )
A.80% B.60% C.50% D.20%
查看习题详情和答案>>|
已知:2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 KJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890 KJ·mol-1 现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 KJ,则原混合气体中H2与CH4的物质的量之比是 | |
| [ ] | |
A. |
1∶1 |
B. |
1∶3 |
C. |
1∶4 |
D. |
2∶3 |
|
已知 :2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 KJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890 KJ·mol-1现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 KJ,则原混合气体中H2与CH4的物质的量之比是 | |
| [ ] | |
A. |
1∶1 |
B. |
1∶3 |
C. |
1∶4 |
D. |
2∶3 |
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
C3H4(g)+4O2(g)=3CO2(g)+2H2O(g) ΔH=-2100.0 kJ·mol-1
根据上面两个热化学方程式回答下列问题:
(1)H2的燃烧热为________;
(2)1 mol H2和2 mol C3H4 组成的混合气体完全燃烧生成液态水时释放的热量为________;
(3)现有H2和C3H4的混合气体共5 mol,完全燃烧生成CO2和气态水时,则放出热量(Q)的取值范围是________;若生成CO2和H2O的物质的量相等,则放出的热量是________.