摘要:A.B.C.D.E.F是元素周期表前四周期的元素.它们在元素周期中的位置如下图所示: (1)写出F的基态原子核外电子排布式: . (2)C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是 . (3)由A.B.D三种元素形成的一种物质俗称光气.分子中A原子采取sp2杂化成键.光气分子的结构式是 .其中碳氧原子之间共价键是 : a.2个σ键 b.2个π键 c.1个σ键.1个π键 (4)EB晶胞如右图所示.EB晶体中E2+的配位数为 .EB晶体和NaCl晶体中离子排列方式相同.其晶格能分别为:EB-3401kJ/mol.NaCl-786kJ/mol.导致两者晶格能差异的主要原因是 . (5)现有含F的两种颜色的晶体.一种为紫色.另一为绿色.它们都是配位数为6的配合物(配离子难电离).相关实验证明.两种晶体的组成皆为FD3·6H2O.为测定这两种晶体的化学式.取等质量的两种晶体分别配成待测溶液.各滴入足量的AgNO3(aq).原绿色晶体的水溶液得到白色沉淀的质量为紫色晶体的水溶液得到白色沉淀质量的2/3 .则紫色晶体配合物的化学式为 .绿色晶体中含有化学键类型是 . 江苏省东台市五烈镇中学2010届高三化学周练
网址:http://m.1010jiajiao.com/timu3_id_415939[举报]
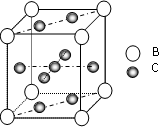 A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:
A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:(1)A、B原子处于基态时,原子核外电子均成对,且核电荷数A>B 写出A的基态外围电子轨道表示式


(2)C与A在周期表同属于一个区的元素,写C2+的核外电子排布式
[Ar]3d9
[Ar]3d9
.(3)图是金属B和C所形成的某种合金的晶胞结构示意图,用最简式表示该合金中的组成
CaCu5
CaCu5
.(用B、C元素符号表示)(4)C2+和A2+都能与NH3、H2O、Cl-等形成配位数为4的配合物.[A(NH3)4]2+和[C (NH3)4]2+都具有对称的空间构型,[C(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,而[A(NH3)4]2+中的两个NH3被两个Cl-取代,只能得到一种产物,则[C(NH3)4]2+的空间构型为
平面正方形
平面正方形
.[A(NH3)4]2+A原子轨道的杂化方式为sp3
sp3
.(5)D、E、F均位于P区,电负性D<E<F,第一电离能D<F<E,D只有一个未成对电子.D在元素周期表中有位置是
第四周期第IIIA族
第四周期第IIIA族
,D、E形成化合物的化学式GaAs
GaAs
,该化合物的一种用途是半导体材料
半导体材料
F的最高价氧化物对水化物的分子式为H2SeO4
H2SeO4
.A、B、C、D、E、F 是六种短周期的主族元素,它们的原子序数依次递增;A元素与其它元素均不在同一周期,C元素与B、D元素同周期相邻;C元素的最高价氧化物对应水化物与C元素的气态氢化物X能相互反应生成盐Y;D、F元素同族,E是短周期主族中原子半径最大的元素.请完成下列问题:
(1)D位于元素周期表第 周期 族.
(2)E原子的结构示意图为 .
(3)D和F两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的事实是
(只写一个即可).
(4)A、D和E三种元素组成的化合物,其所含的化学键类型有 .
(5)检验X的试剂或试纸是 .
(6)由A、C、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性.若甲抑制水的电离,则甲的化学式为 ;若乙促进水的电离,则乙的水溶液呈酸性的原因是(用离子方程式表示) .
(7)写出D、E两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
.
(8)A与D间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式
.
(9)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量,该反应的热化学方程式为 .
(10)D、E、F简单离子半径由大到小的顺序为: (用离子符号表示).
(11)写出A、D两种元素形成的化合物的一种用途 .
查看习题详情和答案>>
(1)D位于元素周期表第
(2)E原子的结构示意图为
(3)D和F两元素相比较,非金属性较强的是
(4)A、D和E三种元素组成的化合物,其所含的化学键类型有
(5)检验X的试剂或试纸是
(6)由A、C、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性.若甲抑制水的电离,则甲的化学式为
(7)写出D、E两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
(8)A与D间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式
(9)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量,该反应的热化学方程式为
(10)D、E、F简单离子半径由大到小的顺序为:
(11)写出A、D两种元素形成的化合物的一种用途
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的次外层电子数比最外层电子数多4,E元素原子的最外层与最内层电子数的差是3.试回答下列问题:
(1)写出下列元素符号:A
(2)用电子式表示B和F形成化合物的过程:
 .
.
(3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式:
查看习题详情和答案>>
(1)写出下列元素符号:A
Na
Na
,CAl
Al
,DSi
Si
,EP
P
.(2)用电子式表示B和F形成化合物的过程:


(3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式:
NaOH+Al(OH)3═NaAlO2+2H2O
NaOH+Al(OH)3═NaAlO2+2H2O
、NaOH+HClO4═NaClO4+H2O
NaOH+HClO4═NaClO4+H2O
、Al(OH)3+3HClO4═Al(ClO4)3+3H2O
Al(OH)3+3HClO4═Al(ClO4)3+3H2O
.(1)有一种叫做钾长石(K2Al2Si6O16),其化学式为写成氧化物的形式为
(2)反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 的离子方程式为:
每生成11.2L标准状况下的气体,被还原的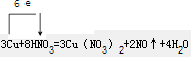
 ;
;
(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应①A+H2O→B+C ②C+F→D ③D+NaOH
F+E+H2O写出A、B、C的化学式A
查看习题详情和答案>>
K2O?Al2O3?6SiO2
K2O?Al2O3?6SiO2
;(2)反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 的离子方程式为:
3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O
;每生成11.2L标准状况下的气体,被还原的
硝酸
硝酸
(填名称)的质量为31.5g
31.5g
.得电子与失电子个数比是1:1
1:1
,被氧化与被还原的原子的个数比为3:2
3:2
,试用“单线桥”标出该反应电子转移方向和数目:

(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应①A+H2O→B+C ②C+F→D ③D+NaOH
| △ |
NO2
NO2
BNO
NO
CHNO3
HNO3
;写出反应③的离子方程式NH4++OH-
NH3+H2O
| ||
NH4++OH-
NH3+H2O
.
| ||
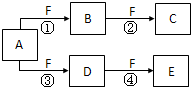 (2011?海淀区二模)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
(2011?海淀区二模)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:(1)Z元素的原子结构示意图为


(2)A的电子式为


HNO3
HNO3
.(3)写出下列反应的化学方程式:①
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
,③
| ||
| △ |
2NH3+3O2
2HNO2+2H2O
| ||
2NH3+3O2
2HNO2+2H2O
.
| ||
(4)A和E反应生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为
NH4NO3
N2O↑+2H2O
| ||
NH4NO3
N2O↑+2H2O
.
| ||