摘要:13.氯化亚铜.白色结晶.微溶于水.不溶于硫酸.稀硝酸和醇.溶于氨水.浓盐酸.并生成配合物.氯化亚铜广泛应用于有机合成.染料.颜料.催化剂等工业. 实验药品:铜丝20 g.氯化铵20 g.65% 硝酸10 mL.36%盐酸15 mL.水. (1)反应①的化学方程式为 .用95%乙醇代替蒸馏水洗涤的主要目的是 . (2)工业化生产时.95%乙醇可通过 方法循环利用.而 . 可直接循环利用. (3)实验室实验时通入O2的速率不宜过大.为便于观察和控制产生O2的速率.宜选择 方案. (4)实验开始时.温度计显示反应液温度低于室温.主要原因是 ,电炉加热升温至50℃时停止加热.反应快速进行.烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑.当 时停止通入氧气.打开瓶塞.沿 口倾出棕色反应液于1 000 mL大烧杯中.加水500 mL.即刻有大量白色沉淀析出.
网址:http://m.1010jiajiao.com/timu3_id_415894[举报]
氯化亚铜(CuCl),白色结晶,微溶于水,不溶于硫酸、稀硝酸和醇,溶于氨水、浓盐酸,并生成配合物,它露置于空气中易被氧化为绿色的高价铜盐.氯化亚铜广泛应用于有机合成、染料、颜料、催化剂等工业.

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
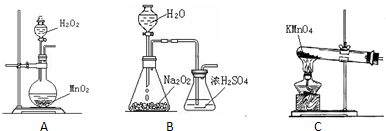
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是
(4)工业化生产时,95%乙醇可通过
查看习题详情和答案>>

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为
NH4[CuCl2]=CuCl↓+NH4Cl
NH4[CuCl2]=CuCl↓+NH4Cl
,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分
避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分
.(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
B
B
方案(填字母序号).
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是
氯化铵溶于水吸收大量热量
氯化铵溶于水吸收大量热量
;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当烧瓶上方红棕色气体逐渐变为无色
烧瓶上方红棕色气体逐渐变为无色
时停止通入氧气,打开瓶塞,沿a或c
a或c
(填字母)口倾出棕色反应液于1 000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.(4)工业化生产时,95%乙醇可通过
蒸馏
蒸馏
方法循环利用,而NH4Cl
NH4Cl
、HNO3
HNO3
可直接循环利用.铜单质及其化合物在很多领域有重要的用途.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl2都是重要的化工原料,常用作颜料、防腐剂和消毒剂等.
Ⅰ.超细铜粉的某制备方法如图1:
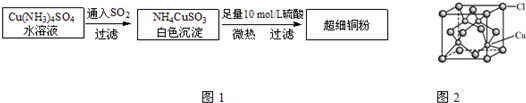
(1)N、O、S三种元素的第一电离能由大到小顺序为
(2)化合物NH4CuSO3中,金属阳离子的核外电子排布式为
(3)化合物Cu(NH3)4SO4中,N原子的杂化方式为
Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为
(6)CuCl的熔点比CuO的熔点
查看习题详情和答案>>
Ⅰ.超细铜粉的某制备方法如图1:

(1)N、O、S三种元素的第一电离能由大到小顺序为
N>O>S
N>O>S
.(2)化合物NH4CuSO3中,金属阳离子的核外电子排布式为
1S22S22P63S23P63d10
1S22S22P63S23P63d10
.(3)化合物Cu(NH3)4SO4中,N原子的杂化方式为
SP3杂化
SP3杂化
,SO42-的空间构型为正四面体
正四面体
.Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
| ||
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
.
| ||
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为
4
4
.(6)CuCl的熔点比CuO的熔点
低
低
(选填“高”或“低”). 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.(1)超细铜粉的某制备方法如下:
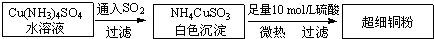
①[Cu(NH3)4]SO4中所含的化学键有
共价键、离子键、配位键
共价键、离子键、配位键
,N、O、S三种元素的第一电离能大小顺序为:N
N
>O
O
>S
S
.(填元素符号)②NH4CuSO3中的金属阳离子的核外电子排布式为:
1S22S22P63S23P63d10或[Ar]3d10
1S22S22P63S23P63d10或[Ar]3d10
.③NH3分子中N原子的杂化方式为:
SP3杂化
SP3杂化
.④SO42-离子的空间构型为
正四面体型
正四面体型
.(2)氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
①出上述制备CuCl的离子方程式:
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
| ||
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
.
| ||
②CuCl的晶胞结构如上图所示,其中Cl原子的配位数为
4
4
.③CuCl的熔点比CuO的熔点
低
低
.(填“高”或“低”)氯化亚铜在工业上应用广泛.氯化亚铜(CuC1)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.
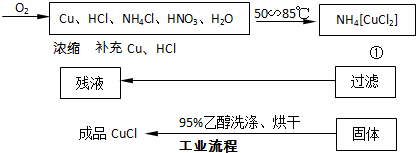
实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为
(2)工业化生产时,95%乙醇可通过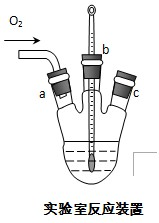
(3)实验室用右图装置制备CuC1.
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择

②实验开始时,温度计显示反应液温度低于室温,主要原因是
查看习题详情和答案>>

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为
NH4[CuCl2]=CuCl↓+NH4Cl
NH4[CuCl2]=CuCl↓+NH4Cl
,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗或洗去晶体表面的杂质离子及水份
避免CuCl溶于水而造成损耗或洗去晶体表面的杂质离子及水份
.(2)工业化生产时,95%乙醇可通过
蒸馏
蒸馏
方法回收并循环利用,而NH4Cl、HNO3
HNO3
(填化学式)可直接循环利用.
(3)实验室用右图装置制备CuC1.
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择
B
B
装置(填字母序号A、B、C).
②实验开始时,温度计显示反应液温度低于室温,主要原因是
氯化铵溶于水吸收大量热量,造成反应液温度降低
氯化铵溶于水吸收大量热量,造成反应液温度降低
;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当烧瓶上方红棕色气体逐渐变为无色
烧瓶上方红棕色气体逐渐变为无色
_时才能停止通入氧气,待冷却至室温后,再打开瓶塞,沿a或c
a或c
(填字母a、b、c)口倾出棕色反应液于1000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.