网址:http://m.1010jiajiao.com/timu3_id_415738[举报]
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
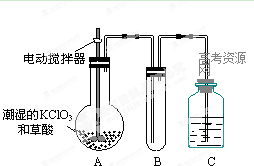
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A中反应还原剂与氧化剂的物质的量之比为1:2,该反应的化学方程式为 。
A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置: ;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 _
(填“A、B或C”),理由是
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发该反应的离子方程式为 。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有 。
查看习题详情和答案>>
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)

(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A中反应还原剂与氧化剂的物质的量之比为1:2,该反应的化学方程式为 。
A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置: ;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 _
(填“A、B或C”),理由是
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发该反应的离子方程式为 。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有 。
查看习题详情和答案>>I.下图为向25mL0.1mol/L NaOH溶液中逐滴滴加0.2moL/L CH3COOH溶液过程中溶液pH的变化曲线
 |
请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间内还是BD区间内? (若正确,此问不答)
(2)关于该滴定实验,从下列选项中选出最恰当的一项


(3)在AB区间内,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)的大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)可能大于、小于或等于C(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。(填“>”、“<”或“=”)
Ⅱ.在温度t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(5)该温度下水的离子积常数Kw=
(6)该NaOH稀溶液中NaOH物质的量浓度的精确值是 mol/L(用含字母的表达式表示)
(7)在该温度下(t℃),将100mL 0.1mol/L的稀H2SO4溶液与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=
查看习题详情和答案>>